중증근무력증의 새로운 치료 약물들
New Therapeutic Agents in Myasthenia Gravis
Article information
Trans Abstract
Myasthenia gravis (MG) is an autoantibody-mediated neuromuscular junction disorder characterized by fatigable muscle weakness. Mainstay therapies for MG include anticholinesterase inhibitor, thymectomy, corticosteroids, and non-specific immunotherapy, such as azathioprine, tacrolimus, mycophenolate mofetil, intravenous immunoglobulin, and plasma exchange. These therapeutic methods have significantly improved MG treatment in recent decades. However, there are still some patients with MG refractory to conventional treatments. In addition, long-term use of corticosteroids and non-specific immunosuppressants can lead to serious complications, including metabolic derangement, infections, malignancies, and systemic organ dysfunction. Recently, new therapeutic agents have been developed based on advancements in our understanding of the immunopathogenesis of MG. These agents are more specific and have a more rapid effect compared with conventional treatments. This article reviews novel therapeutic agents and their scientific basis.
서론
중증근무력증(myasthenia gravis, MG)은 수의근(voluntary muscle)의 힘 빠짐과 피로 현상이 특징인 신경근육접합부 질환이며, 아세틸콜린수용체(acetylcholine receptor, AChR)와 muscle-specific tyrosine kinase (MuSK) 등 신경근육접합부 연접후막에 발현되는 단백질에 대한 자가항체가 발병기전에 깊게 연관된 만성 항체매개자가면역질환(antibody mediated autoimmune disease)이다.1 중증근무력증은 호흡마비와 삼킴장애 등을 일으켜 생명을 위태롭게 할 수 있는 질환이지만 여러 치료법들이 발전하면서 최근에는 대부분 환자가 적절한 치료를 받으면 안정적으로 일상생활과 직업에 큰 지장이 없이 지낼 수 있게 되었다. 중증근무력증의 사망률은 1900년대 초반까지만 해도 80% 이상이었으나, 기계환기(mechanical ventilation), 아세틸콜린에스터분해효소 억제제, 흉선절제술, 코티코스테로이드, 면역억제제, 치료적 혈장교환술, 면역글로불린정맥주사 등이 도입되면서 사망률이 1990년대 이후로는 5% 이하로 현저히 낮아졌다.2-4 하지만 아직까지 10-15%의 중증근무력증 환자들은 현재의 치료법들로는 질병이 잘 조절되지 않는다.5-7 또한 환자들은 중증근무력증의 치료를 위하여 비특이적인 면역억제 치료를 장기간 지속해야 하며 이로 인한 유해 효과(adverse effect)가 중증근무력증의 치료를 어렵게 하고 환자들의 삶의 질에 악영향을 끼친다.8
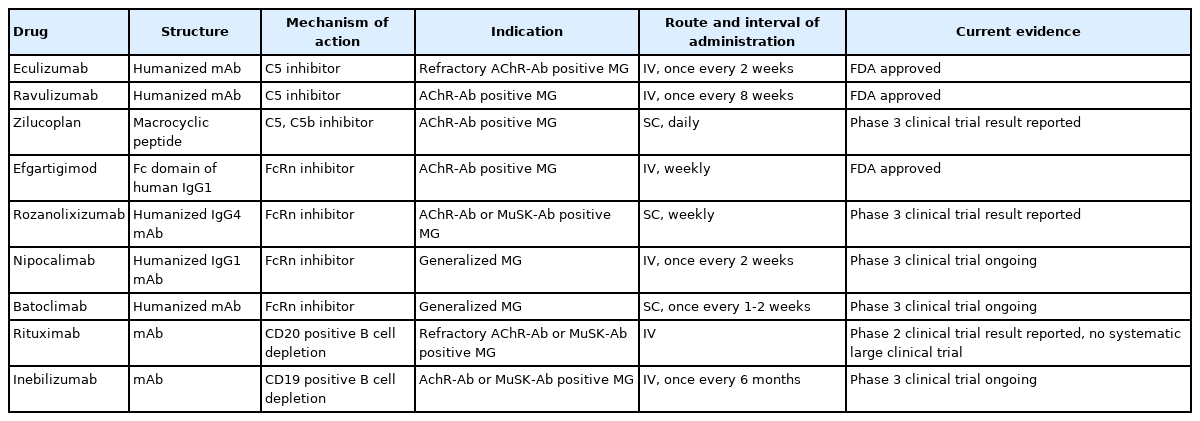
최근 들어 중증근무력증의 발병기전에 대한 이해가 점차 깊어지면서 발병기전에 중요한 물질들에 특이적으로 작용하는 치료 약제들이 활발히 개발되고 있다. 이러한 약제들로 중증근무력증의 치료가 개선될 것으로 기대된다. 본 종설에서는 최근에 새로 개발되었거나 개발 중인 주요 중증근무력증 치료 약제들을 살펴보고자 한다(Table 1).
본론
보체억제제(complement inhibitor)
보체(complement)는 선천면역계(innate immune system)의 중요 구성요소로 항체에 의하여 활성화되고 막공격복합체(membrane attack complex, MAC)를 형성하여 세균 등 병원체(pathogen)의 세포막을 파괴하고 포식세포(phagocyte)를 통하여 병원체(pathogen)를 제거하거나 염증을 일으킨다.9 아세틸콜린수용체항체(acetylcholine receptor antibody, AChR-Ab) 양성 중증근무력증의 발병기전에도 보체 활성화(complement activation)가 관여되어 있다. AChR-Ab의 면역글로불린 동형(isotype)은 주로 immunoglobulin G (IgG) 1과 IgG3로,10 AChR-Ab는 보체를 활성화시킬 수 있으며 MAC를 형성하여 AChR이 위치하는 연접후막(post-synaptic membrane)의 구조를 파괴한다.9 AChR-Ab 양성 중증근무력증 환자의 손상된 신경근육접합부에서 보체계(complement system) 구성 단백질인 C3와 C9의 침착이 확인되었다.11-13 그리고 중증근무력증 동물모델에 MAC 형성을 억제하거나, 보체유전자를 제거한 동물에 중증근무력증을 유발시킬 경우에는 신경근육전달 기능이 유지되었다.14 또한 중증근무력증을 유발시킨 동물에 보체 단백 C5에 대한 단클론항체(monoclonal antibody)를 적용하였을 때 중증근무력증 동물의 근력이 회복되었다.15,16 이러한 근거들을 바탕으로 C5를 표적으로 하는 중증근무력증 치료제들이 개발되고 있다.
Eculizumab
Eculizumab은 보체단백에 C5에 대한 인간화단클론항체(humanized monoclonal antibody)로 보체억제제로서는 처음으로 개발된 치료 약물이다. Eculizumab은 C5에 결합하여 C5가 C5a와 C5b로 갈라져 나뉘어지는 것을 막는다. 따라서 C5a에 의한 염증세포들의 유입이 제한되며, C5b가 주요 구성요소 중 하나인 MAC의 형성이 억제된다. 이 약물은 보체매개자가면역질환(complement mediated autoimmune disease)인 발작성야간혈색뇨(paroxysmal nocturnal hemoglobinuria)와 비정형 용혈요독증후군(hemolytic uremic syndrome)의 치료제로 먼저 승인받았으며,15,17 최근에는 아쿠아포린4항체(aquaporin 4 antibody) 양성 시신경척수염범주질환(neuromyelitis optica spectrum disorder)의 치료제로도 승인을 받았다.18
AChR-Ab 양성 불응성 중증근무력증 환자 125명을 대상으로 한 3상 임상시험 REGAIN의 결과가 2017년도에 발표되었다. 위약군에는 63명, eculizumab 투약군에는 62명이 배정되었다. Eculizumab을 첫 4번은 매 7일마다 900 mg씩 그리고 네 번째 용량 투여 7일 후에 다섯 번째 용량으로 1,200 mg을 투여하였고, 그 후부터는 매 14일마다 총 26주간 1,200 mg을 투여하였다. 일차 평가 지표인 26주 후 Myasthenia Gravis Activity of Daily Living (MG-ADL) 점수의 변화에서는 유의한 결과를 얻지 못하였으나, Quantitative Myasthenia Gravis score(QMG), Myasthenia Gravis Composite (MGC), Myasthenia Gravis Quality of Life 15 (MG-QOL-15) 점수 감소 등의 이차 평가 지표에서 유의미한 개선을 보였다.19 중증근무력증 악화(MG exacerbation) 발생률이 eculizumab군에서는 10%였고 위약군에서는 24%였으며, 정맥면역글로불린(intravenous immunoglobulin, IVIg)과 혈장교환술(plasma exchange, PLEX) 등 급성기 구제 치료(rescue therapy)를 받은 환자 빈도도 eculizumab군에서는 10%였고 위약군에서는 19%였다. Eculizumab의 치료 효과는 첫 투약 4주 이내에 나타나기 시작하였고 대부분의 치료 효과는 12주 이내에 도달하였다. 부작용으로는 두통과 비인두염 등 경미한 정도의 부작용이 가장 많았으며, 주요한 부작용으로는 나이세리아 수막구균 감염 위험이 있었다. 이 결과를 바탕으로 중증근무력증의 치료제로서 2017년 미국 Food and Drug Administration (FDA) 승인을 받았다.20
REGAIN 임상시험을 완료한 117명의 불응성 중증근무력증 환자 117명이 공개라벨연장(open label extension) 연구에 참여하였고 매 14일마다 1,200 mg의 eculizumab을 투약하며 관찰 기간은 평균 22.7개월이었다. 중증근무력증 악화 발생률은 REGAIN 연구 시작 전에 비하여 75% 감소하였고 REGAIN 연구에서 확인된 근력 호전, 일상생활 활동 개선, 삶의 질 개선 등 eculizumab 효과가 3년 내내 유지되었다. 또한 대상자의 56%가 최소발현(minimal manifestation) 상태 혹은 약물적 완화(pharmacological remission)에 도달하였다.21 이 공개라벨연장 연구에서 대상자의 절반 가까이는 코티코스테로이드를 포함한 면역억제제를 중단하거나 투약 용량을 감량하였는데, 공개라벨연장 연구 시작과 마지막 약물 용량을 비교하였을 때 코티코스테로이드는 평균 60.8%, 아자싸이오프린(azathioprine)은 89.1%, 마이코페닐레이트모페틸(myophenolate mofetil)은 56.0% 감량되었다.22 REGAIN 연구에 참여하기 전 IVIg를 1년에 4회 이상 투약, 즉 중증근무력증의 유지요법으로 IVIg를 사용하였던 환자들에서도 eculizumab의 효과는 18개월 기간 동안 지속적으로 유지되었다.23 대한민국과 같은 동아시아 국가인 일본에서 수행된 eculizumab 시판 후 조사 연구에서 36명의 중증근무력증 환자들에서 eculizumab의 효과와 안정성은 REGAIN 연구 결과와 유사하였다.24
Eculizumab은 비교적 안전한 약물로 받아들여지고 있다. 이 약제는 처음 발작성야간혈색뇨에서 허가받아 10년 이상 사용되고 있고 중증근무력증에서도 5년 정도의 임상 경험이 있는데, 안전성 측면에서 별다른 이슈 없이 이용되고 있다. 또한, eculizumab은 다른 면역억제제와 함께 사용하거나, 또는 rituximab 치료 후 사용한 경우에도 그렇지 않은 경우와 비교하여 안정성에 차이가 없음이 보고되었다.22,25,26 안정성 측면에서 가장 주의하여야 할 점은 수막구균(Neisseria meningitidis) 감염이다. 보체활성화에 따른 MAC 형성은 수막구균을 포함한 그람음성(gram-negative)균에 대한 주요 방어기전이다.27 따라서 eculizumab은 수막구균 감염 위험성을 증가시키며, 실제로 이 약물의 투여 환자에서 수막구균 감염이 발생하였다. 수막구균감염을 예방하기 위하여, 이 약물을 투여하는 모든 환자들은 이 약물의 투여 시작 최소 2주 전에 수막구균 예방접종을 받아야 한다. 만약 예방 접종을 받지 않은 환자가 긴급히 eculizumab 치료를 받아야 하면, 최대한 빨리 수막구균 백신을 투여받아야 하며 백신 접종 후 2주 동안 적절한 예방적 항생요법으로 치료를 받아야 한다.28 수막구균에 대한 예방 접종과 예방적 항생요법 치료는 eculizumab을 포함한 모든 C5억제제에 해당된다. 국내에서도 전신형 중증근무력증에서 eculizumab이 허가를 받은 상태이지만 약가 협상이 이루어지지 않아 아직 사용되고 있지 못하는 상황이다. 약가는 솔리리스(eculizumab) 300 mg 한 병에 513만 원으로 연간 약 5억의 비용이 든다.
Ravulizumab
Ravulizumab도 C5에 대한 단클론항체로 eculizumab과 작용 기전이 유사하나, Fc 부분의 아미노산 치환을 통해 반감기를 늘려 장시간 효과를 내도록 개발된 약이다. 반감기를 늘림으로써 8주에 한 번 투약으로 치료 효과를 유지할 수 있어, 격주에한 번 투약이 필요한 eculizumab보다 더 긴 간격으로 투약이 가능하다는 장점이 있다.29
Ravulizumab의 3상 임상시험 CHAMPION은 AChR-Ab 양성 중증근무력증 환자 175명을 대상으로 시행되었으며, 체중에 따라 1일차에 ravulizumab 2,400-3,000 mg을 투여하였고, 15일 뒤부터는 8주마다 3,000-3,600 mg의 유지용량을 주사하였다. 일차 평가 지표인 26주 후 MG-ADL 점수 차이에서 위약군에 비해 유의한 효과가 있었으며, 이차 평가 지표인 QMG 점수의 저하에도 효과가 있는 것으로 보고하였다. 이러한 효과는 치료 시작 1주일 이내에 나타나 26주 내내 지속되었다.30 이 임상시험 결과를 바탕으로 2022년 4월 미국 FDA 승인을 받았다.31
Zilucoplan
Zilucoplan은 C5에 결합하는 특성을 지닌 15개의 아미노산으로 구성된 큰고리펩티드(macrocyclic peptide)이며 분자량이 3.5 kDa으로 단클론항체에 비하여 현저히 낮고 환자가 스스로 피하주사하여 투약한다.32 Zilucoplan은 여러 아미노산이 고리를 이루고 있어 구조적으로 안정적이고 C5에 아주 강하게 결합한다는 특징이 있으며, C5의 분해를 막는 것뿐만 아니라 C5b가 C6에 결합하는 것도 막는 두 가지 작용기전을 가졌다.32,33 최근 3상 시험 RAISE의 결과가 발표되었으며, 239명의 AChR-Ab 양성 환자를 대상으로 하였다. 치료군에게 12주간 매일 zilucoplan 0.3 mg/kg을 피하주사로 투약하도록 하였으며, 그 결과 치료군의 MG-ADL 점수가 위약군에 비해 유의하게 개선되었다. 가장 흔한 치료 관련 부작용은 주사부위의 멍이었으며, 심각한 부작용의 발생 비율은 두 군에서 비슷한 것으로 보고하며 안전성을 입증하였다.34
그 외
Pozelimab은 C5에 대한 인간화IgG4단클론항체로 C5 생성을 억제하는 짧은간섭RNA (small interfering RNA) cemdisiran과 동시에 투약하는 치료법이 중증근무력증 대상으로 임상시험 중에 있다.35 Gefurulimab는 C5와 알부민에 결합하는 이중특이항체(bi-specific antibody)로 피하주사로 투약하며 현재 전신형 중증근무력증 환자들을 대상으로 3상 임상시험 중에 있다.36 C5뿐만 아니라 C1과 C3을 표적으로 하는 보체억제제들도 중증근무력증의 치료제로 가능성이 제기되고 있다.25 또한 보체의 대체경로(alternative pathway)에서 C3전환효소(C3 convertase) 형성에 필요한 Factor D를 억제하는 경구 약제인 vemircopan도 2상 임상시험 중에 있다.37
Neonatal Fc receptor (FcRn) 억제제(FcRn inhibitor)
중증근무력증은 자가항체매개질환으로 AChR과 MuSK 등에 대한 자가항체가 발병기전에 중요한 역할을 한다. AChR-Ab의 동형은 주로 IgG1과 IgG3이며, 보체 활성화를 통한 신경근육접합부 파괴, 항원조정(antigenic modulation)으로 인한 AChR 분해 증가 그리고 아세틸콜린의 AChR 결합 차단 등의 기전으로 신경근육 전달을 방해한다.38 MuSK는 신경근육접합부의 형성과 유지에 관여하는 막관통단백질(transmembrane protein)로 AChR의 집락화(clustering)에 중요한 역할을 한다. MuSK 항체(MuSK-Ab)는 주로 IgG4 동형이며, MuSK와 LRP4-agrin 복합체 사이의 결합을 방해하여 AChR의 집락화가 이루어지지 않게 하여 신경근육 전달에 문제를 일으킨다.39 이 자가항체들을 제거하는 치료법인 혈장교환술은 근무력위기(myasthenic crisis)나 빠르게 악화되는 중증근무력증 치료에 널리 이용되고 있다.40
신생아Fc수용체는 1형 주조직적합복합체(major histocompatibility complex class I) 유사 단백질로 혈청 IgG를 재활용하여, FcRn에 의하여 재활용되지 않는 다른 면역글로불린(예, IgM과 IgA)에 비하여 IgG의 반감기를 약 4배 정도 연장시킨다.41 혈청 IgG가 혈관 내피세포(endothelial cell)의 포음작용(pinocytosis)으로 세포안으로 섭취된 이후 섭취소체(endosome) 안 환경이 산성화되면 IgG의 Fc 부분이 FcRn에 결합된다. 엔도솜 안의 결합되지 않은 물질들은 용해소체(lysosome) 안에서 분해되는데 FcRn에 결합한 IgG는 분해되지 않고 다시 세포 밖으로 배출되고 세포 밖의 생리적인 pH에서 FcRn과 분리되어 혈청으로 떨어져 나가 재활용된다.42 그러므로 중증근무력증과 연관된 IgG 자가항체들 또한 FcRn에 의하여 재활용될 것이다. 이러한 개념을 바탕으로 FcRn의 기능을 억제하여 중증근무력증과 연관된 IgG 자가항체들을 제거하려는 치료 약제들이 개발되고 있다.43
Efgartigimod
Efgartigimod는 FcRn에 대한 친화력을 높이도록 설계된 human IgG1의 Fc domain이다. 내인성 IgG에 비해 FcRn과의 친화력이 높아 IgG와 경쟁적으로 FcRn에 결합하면서 IgG의 재활용을 억제한다. 또한, efgartigimod는 내인성 IgG와 마찬가지로 pH 의존적으로 FcRn에 결합하여 FcRn을 통해 재활용되고, 따라서 반감기가 길다.44
2021년 발표된 3상 임상 연구 ADAPT는 MG-ADL 점수가 5점 이상인 중증근무력증 환자를 대상으로 시행되었다. 총 대상자 167명 중 AChR-Ab 양성 환자는 129명(77%)이었고, AChR-Ab 음성 중증근무력증 환자는 38명(23%)이었다. AChR-Ab 음성 환자 중 6명은 MuSK 항체 양성이었다. Efgartigimod 투약군에는 84명 위약군에는 83명이 배정되었다. Efgartigimod군 대상자는 매주 10 mg/kg의 efgartigimod를 총 네 차례 정맥주사로 투약받았으며 이후 증상에 따라 최소 8주 이상의 간격을 두고 네 차례의 투약을 반복할 수 있었다. AChR-Ab 양성 환자군에서 치료 시작 4주째 평가한 MG-ADL 점수가 2점 이상 호전된 환자 비율(일차 목적)이 위약군에 비해 유의하게 높았다. 위약군에 비하여 efgartigimod군에서 MG-ADL, QMG, MGC, MG-QOL-15 평가 지표들이 유의미하게 호전되었으며, 이 효과의 차이는 투약 1주째부터 관찰되었고 7주간 지속되었으며 최대 호전은 4-5주째 확인되었다. 이러한 임상적 호전과 함께, efgartigimod군에서 총 IgG 혈중 농도가 약물 투약 4주째 최대로 평균 61.3% 감소되었고, AChR-Ab 역가(titer)도 총 IgG 수치와 비슷한 양상을 보이며 57.6% 감소되었다. 총 IgG와 AChRAb 혈중 농도는 투약 시작 12주 즉, 마지막 투약 9주째 투약 이전 수준으로 돌아왔다. 혈청 알부민 농도는 감소되지 않았다. Efgartigimod는 내약성이 매우 우수하였고, 두통, 비인두염, 오심, 설사, 상기도감염 및 요로감염 등의 경미하거나 중등도의 이상 반응이 보고되었으나 이 발생률은 efgartigimod군과 위약군에서 서로 비슷하였다.45 이러한 임상시험 결과를 바탕으로 efgartigimod은 FcRn 억제제로서는 처음으로 AChR-Ab 양성 중증근무력증에서 FDA 승인을 받았다.46
Rozanolixizumab
Rozanolixizumab은 FcRn에 대해 강하게 결합하는 인간화 IgG4단클론항체로, 정맥주사제제인 efgartigimod와 다르게 피하주사로 투여하도록 개발되었다. 전신형 중증근무력증 환자 43명을 대상으로 수행된 2상 임상시험에서 rozanolixizumab 투약군이 위약군에 비하여 MG-ADL 점수가 현저히 개선되었고, 최대 68%의 총 IgG와 AChR-Ab 혈중 농도 감소가 확인되었다.47 최근 AChR-Ab 또는 MuSK-Ab 양성 전신 중증근무력증 환자 200명을 대상으로 한 3상 임상시험 MycarinG의 결과가 발표되었다.48 AChR-Ab 양성 환자는 179명, MuSK-Ab 양성은 21명이었다. 환자들은 6주간 매주 rozanolixizumab 7 mg/kg (66명), rozanolixizumab 10 mg/kg (67명) 혹은 위약(67명)을 피하주사로 투여받았으며, 치료 시작 43일 후 두 치료군 모두 위약군에 비해 MG-ADL 점수가 크게 개선되었다. 치료와 연관된 이상 반응으로는 두통, 설사, 발열이었다. 중대한 이상 반응은 rozanolixizumab 7 mg/kg군에서 5명(8%), rozanolixizumab 10 mg/kg군에서 7명(10%), 위약군에서 6명(9%)에서 나타났으며, 사망은 발생하지 않았다.
Nipocalimab
Nipocalimab은 pH에 무관하게 FcRn에 강하게 결합할 수 있는 인간화 IgG1 단클론항체로, 혈중 IgG 수치를 85% 감소시키며, 이러한 효과는 24일간 유지된다.49 Nipocalimab 2상 연구 Vivacity-MG는 항체와 무관하게 전신 중증근무력증 환자 68명을 대상으로 진행되었으며, 용량이 다른 4개의 투약군과 1개의 위약군으로 나누어졌다. 8주 후 위약군에 비해 치료군에서 용량 의존적인 IgG 및 anti-AChR 항체 수준의 감소가 관찰되었으며 이는 임상적 개선과 연관되어 있었다.50
성인 중증근무력증 환자를 대상으로 한 3상 무작위 대조 연구(NCT04951622)가 진행되고 있으며, 이 시험은 중증근무력증 치료제로서 nipocalimab의 효과 및 안전성에 대한 추가 정보를 제공할 것으로 기대된다.51 이에 더하여 nipocalimab은 신생아용혈성빈혈에 대한 고위험 임산부를 대상으로도 임상시험이 이루어지고 있다(NCT03842189) .52 대부분의 임상시험이 임산부를 제외하는 점과 상당수의 중증근무력증 환자들이 가임기 여성인 상황을 고려할 때 임산부에서 nipocalimab 사용에 대한 임상시험 결과가 기대된다.
그 외
Batoclimab이라는 FcRn 억제제 또한 중국에서 30명의 전신형근무력증 환자들을 대상으로 2상 임상시험이 시행되었고, 현재 3상 임상시험이 진행 중이다.53
B세포 표적 치료(therapy targeting B cell)
B세포는 T세포의 영향을 받아 기억B세포(memory B cells), 형질모세포(plasmablast), 형질세포(plasma cell)로 분화한다. 형질세포와 형질모세포는 항체를 만들어 분비한다. 중증근무력증과 연관된 자가항체들도 이들 형질세포와 형질모세포에서 생성되어 분비되며 따라서 B세포는 중증근무력증 발병기전에 중요한 역할을 하는 것으로 받아들여지고 있다.54 B세포는 항체 생성뿐만 아니라 항원제시(antigen presentation)와 interleukin (IL)-1, IL-6, IL-10과 같은 사이토카인(cytokine)의 분비를 통하여서도 중증근무력증 발병에 연관되어 있다.54 따라서 B세포를 표적하는 치료법은 중증근무력증 관련 자가항체 생성을 억제하고 중증근무력증에서 초래된 면역 상태의 불균형과 연관된 요인들에 영향을 미칠 것으로 추정된다.
Rituximab
Rituximab은 CD20를 표적으로 하는 단클론항체로 CD20을 발현하는 B세포를 제거하여 항체 생성을 억제한다. Rituximab은 말초혈액 내 성숙B세포(mature B cell)와 기억B세포(memory B cell)를 빠르게 파괴하는 반면에 골수와 이차림프기관(secondary lymphoid organ)에 위치하는 pre-B세포와 형질세포들은 대부분 보존된다. B세포 고갈 효과는 말초혈액 내 B세포는 골수에서부터 재증식되어 보충되기 전까지 대략 6개월 정도 지속된다.55
단명성형질모세포(short-lived plasmablast)와 조절B세포(regulatory B cell)는 CD20을 발현하여 rituximab에 의하여 파괴되며, 장명성형질세포(long-lived plasma cell)는 CD20을 발현하지 않기 때문에 rituximab에 영향을 받지 않는다.56 AChR-Ab는 장명성혈질세포에서 생성되는 반면 MuSK-Ab는 단명성 형질모세포에서 생성되는 분비되는 것으로 알려져 있다.57 따라서 이 이론적 근거를 바탕으로 AChR-Ab 양성 중증근무력증보다 MuSK-Ab 양성 중증근무력증에서 rituximab이 더 효과적인 이유를 설명하기도 한다.
중증근무력증에서 rituximab의 유효성을 밝히고자 한 연구는 대부분 후향적이거나 소규모로 진행된 연구였다. BeatMG는 2상 임상시험으로 하루 최소 15 mg의 프레드니솔론 투여를 필요로 하는 AchR-Ab 양성 전신 중증근무력증 환자 52명을 대상으로 rituximab을 2주간 매주 375 mg/m2로 투약 후 6개월 간격으로 투약을 반복하며 위약과 효과를 비교한 연구였다. 연구 결과 심각한 부작용은 관찰되지 않았으나, 일차 평가 지표인 rituximab의 스테로이드 감량 효과는 증명하지 못하였다.58
Rituximab의 유효성을 중증근무력증의 원인 항체에 따라 분석한 연구들에서 AChR-Ab 양성 및 MuSK-Ab 양성 두 군 모두에서 rituximab의 효과는 긍정적인 것으로 보고하였으나,59-61 항체 종류에 따라 효과의 정도에 차이가 있었다.59 Tandan 등59은 rituximab 치료 후 최소발현 상태를 달성한 환자의 비율이 MuSK-Ab 양성군에서 72%이고, AChR-Ab 양성군에서 30%였으며, 치료 후 재발이 MuSK-Ab 양성군에서 더 적어 MuSK-Ab 양성 중증근무력증 환자에서 더 효과적인 것으로 보고하였다.
아직은 rituximab의 중증근무력증에 대한 유효성에 대한 증명은 불충분한 상태로, 중증근무력증의 치료제로는 승인되지 않았다. 하지만 2020년 국제 진료지침은 MuSK-Ab 양성 중증근무력증 환자에서 rituximab을 초기 치료제로 사용하도록 권고하고 있으며, AChR-Ab 양성 중증근무력증 환자에서의 사용에 대해서는 불확실성이 남아 있다고 언급하고 있다.62
Rituximab의 부작용은 환자의 4.2-26.1%에서 보고되었으며, 주요 부작용으로는 주사 관련반응, 혈구감소증, 기회감염의 증가 및 저감마글로불린혈증 등이 있다. 대부분의 감염은 경미하지만, 중증감염 및 패혈증은 사망에 이를 수도 있어 면밀한 관찰이 필요하다.59,63-65
Inebilizumab
Inebilizumab은 CD19에 대한 단클론항체로 CD19를 발현하는 B세포를 고갈시킨다. CD19는 CD20을 발현하지 않는 B세포 즉, 말초혈액과 이차림프기관 내 초기 pro-B세포와 대부분의 형질세포들 그리고 골수에 위치한 약 절반 정도의 형질세포에서도 발현되기 때문에 CD20 표적 치료제에 비해 더 다양한 종류의 B세포를 표적으로 할 수 있다.66
Inebilizumab은 2020년 aquaporin-4 항체 양성 시신경척수염 치료제로 FDA 승인을 받았다.18 현재 AChR-Ab 양성 혹은 MuSK-Ab 양성 중증근무력증 환자들을 대상으로 inebilizumab을 추가하였을 때 치료 효과를 확인하기 위한 3상 임상시험인 Myasthenia gravis Inebilizumab Trial (MINT, NCT04524273)이 진행되고 있다.67
Bortezomib
Bortezomib은 단백질을 분해하는 세포 구조인 프로테아솜(proteasome)의 활성 억제제로, 프로테아솜은 세포 내부에서 생산되는 단백질의 분해를 담당하는 중요한 세포 구조 중 하나이다.68 Bortezomib은 암세포의 분열과 성장에 필요한 프로테아솜 활성을 억제함으로써 림프종, 다발성 골수증 등에 효과가 있는 것으로 보고되었다.69,70
중증근무력증의 경우, 코티코스테로이드, IVIg, PLEX, rituximab 치료에 반응이 없던 환자에서 bortezomib 투약 후 빠르게 증상이 호전되었다는 증례가 보고되었다.71 항체의 생성과 분해에 관여하는 형질세포의 기능을 억제하여, 이로 인한 항체 생성을 감소시키는 것으로 추정된다.72 중증근무력증을 포함한 항체매개 자가면역질환에서 bortezomib의 단일기관 연구가 계획되었으나 모집이 어려워 중단되었다.73
결론
최근 개발되었거나 개발 중인 새로운 중증근무력증 치료법들은 중증근무력증의 발병기전에 중요한 역할을 하는 보체, 자가항체, B세포를 표적으로 하여 보체를 억제하여 신경근육접합부의 파괴를 막고, FcRn를 억제하여 중증근무력증 관련 자가항체를 혈액에서 빠르게 제거하며, B세포 고갈을 통하여 자가항체 생성을 억제하는 작용기전을 지니고 있다. 중증근무력증 환자들의 10-15%는 기존 치료법으로 조절이 불충분하고 많은 환자들이 장기간의 비특이적 면역억제 치료와 연관된 합병증으로 고통받고 있다. 지금까지 살펴본 새로운 약제들은 불응성 중증근무력증 환자에 중증근무력증 증상 개선 효과를 보이고, 비특이적인 면역억제제 투여량을 줄여 이 약제들의 합병증도 개선하고 합병증 발생을 예방하여 중증근무력증 환자들의 건강과 삶의 질을 증진시킬 것으로 기대된다. 또한 중증근무력증의 치료에 이용되는 면역억제제들이 효과가 나타나기까지 수개월 이상의 시간이 소요되는데 비하여 보체억제제와 FcRn 억제제는 투약 1-2주부터 증상 개선을 보여 앞으로 중증근무력증의 치료 방법이 크게 바뀔 것으로 예상된다. 아직 이 신약들의 장기간 안정성에 대한 우려는 남아 있어 이에 대한 연구가 필요하다. 또한 현실적으로 일 년에 수억이 드는 약값은 이 치료법들이 널리 이용되기 어려운 조건이다. 제약사와 정부 양측 모두 환자 중심으로 접근하여 약가를 합리적으로 협상하여 중증근무력증 신약의 접근성이 증진되고 중증근무력증 환자들에게 신약 도입의 이득이 돌아가기를 바란다.