코로나19 예방 접종을 포함한 중추신경계 탈수초성 질환의 예방 접종 진료 지침에 대한 고찰
A Review for Vaccination Guidelines in Patients with Central Nervous System Demyelinating Diseases including COVID-19 Vaccination
Article information
Trans Abstract
Since coronavirus disease 2019 (COVID-19) pandemic by severe acute respiratory syndrome coronavirus-2, several vaccines for COVID-19 have been approved for use and vaccination is encouraged worldwide. Despite these circumstances, it remains still controversial to vaccinate patients with central nervous system (CNS) demyelinating diseases such as multiple sclerosis (MS) or neuromyelitis optica spectrum disorders using immunosuppressive agents. We reviewed recent studies about vaccination, including COVID-19 vaccination in patients with CNS demyelinating diseases. Also, we summarized updated guidelines about vaccinations for patients with MS. According to recent guidelines, regular vaccinations are recommended for patients with CNS demyelinating diseases and most immunosuppressants or immune-modulating agents did not affect the efficacy of vaccinations. However, several treatments such as rituximab should be adjusted treatment schedules before vaccination. Through this review, clinicians will be given useful information to choose the best vaccination strategy according to current evidence and expert knowledge.
서론
코로나바이러스감염증-19(코로나19)가 전 세계적으로 유행하면서 코로나19 감염 예방을 위한 백신이 개발되었으며 현재까지 개발된 백신의 코로나19 감염 예방 효과는 약 70-95%에 이르는 것으로 알려져 있다. 코로나19 백신이 개발된 초기 코로나19 백신 접종 후 척수염 증례가 언론에 보도되면서 일부 국민들은 코로나19 백신 접종을 주저하기도 하였다. 그러나 2021년 2월 첫 예방 접종이 시행된 이래로 정부의 지속적인 백신 접종 캠페인에 힘입어 2022년까지 우리나라의 코로나19 백신 2차 접종 완료율은 약 90%에 이르며 2023년에도 65세 인구의 약 40%는 코로나19 백신을 접종하였다1-4.
일반적으로 예방 접종은 기저질환이 있는 면역저하자에게 더 강조된다. 중추신경계 탈수초성질환(central nervous system demyelinating disease)인 다발경화증(multiple sclerosis), 시신경척수염(neuromyelitis optica spectrum disorder)으로 면역역제제를 복용하는 환자들은 기회 감염에 더 취약하고, 감염병 발병 이후 중증도가 높아질 수 있으므로 예방 접종이 필요하다. 이에 발맞춰 대한신경면역질환학회에서도 질환별 코로나19 백신 접종에 대한 권고 사항을 안내하여 해당 질환을 진료하는 임상 의사들에게 실질적인 도움을 주고 있다5,6.
이 글에서는 최근 개발된 코로나19 예방 접종과 대표적인 신경계 탈수초성 자가면역질환인 다발경화증과 시신경척수염과 관련한 연구 결과를 정리하고, 중추신경계 탈수초성 질환의 예방 접종과 관련한 주의 사항 및 약물 조절에 대해서 정리하고자 한다.
본론
중추신경계 탈수초성 질환과 코로나19 백신
일반적으로 코로나19 감염을 예방하는 이점이 중추신경계 자가면역질환 재발로 인한 위험보다 크다고 생각하기 때문에 중추신경계 자가면역질환 환자에게 백신접종을 권장하고 있지만, 7 잠재적인 면역 활성화에 대한 위험이 존재한다. 여러 연구에서 백신과 신경계 탈수초성 자가면역질환 발병의 연관성을 조사하였다. 항B형간염백신이나 항인유두종바이러스(human papilloma virus, HPV) 백신 접종과 신경계 자가면역질환의 발병 또는 재발 위험은 연관성이 없는 것으로 나타났다.8-14 일부 연구에서 항B형간염15,16 또는 항HPV 17,18, 인플루엔자19 백신 접종 후 위험이 증가한다고 제안하였으나, 개별 사례 보고에 그치는 한계가 있었다.
최근의 한 연구에서는 치료를 받지 않는 시신경척수염 환자에게서 백신과 관련한 재발의 위험성이 높다고 보고하였다19. 반면, 면역억제제 치료를 받는 환자들은 백신 접종과 재발의 연관성이 뚜렷하지 않았으며, 오히려 정기적인 백신을 접종하면서 연간 재발률도 낮아지는 경과를 보였다고 하였다. 이를 검증하기 위해서는 추가적인 전향적 연구가 필요하겠지만 이 연구를 토대로 환자에게 면역억제 치료와 동시에 감염에 대한 정기적인 예방 접종을 권고할 수 있겠다.
코로나19 백신과 관련한 신경계 탈수초성 자가면역질환에 대한 연구는 많지 않으며 백신 접종과 중추신경계 탈수초성 질환 발병 사이의 인과관계는 확실하지 않다. 2022년 발표된 체계적 고찰 연구에서는 코로나19 백신 접종 이후 발병한 중추신경계 탈수초성 질환 32건을 정리하여 발표하였는데 바이러스벡터 백신인 아스트라제네카 백신 접종 후 8건, 얀센 백신 접종 후 1건, 메신저 RNA (mRNA) 백신인 화이자 백신 접종 후 11건 등이 보고되었다.20 이 중 71.8%는 첫 번째 백신 접종 약 9일 후 중추신경계 탈수초성 질환과 관련한 이상 증상이 발생하였다. 중추신경계 탈수초성 질환의 경우 백신의 종류에 따라 mRNA 기반 백신에서 53.1% (17/32), 바이러스벡터 백신에서 31.3% (10/32), 합성항원 백신에서 15.6% (5/32) 순으로 발병하였고 대부분은 급성기 치료로 신경학적 이상 증상이 호전되었다. 향후 코로나 19 백신과 탈수초성 질환의 인과성을 평가하고 백신의 안정성을 보장하기 위해서는 장기적인 추적 관찰이 필요할 것이다.
면역저하자의 백신 접종에 대한 일반적인 권고 사항
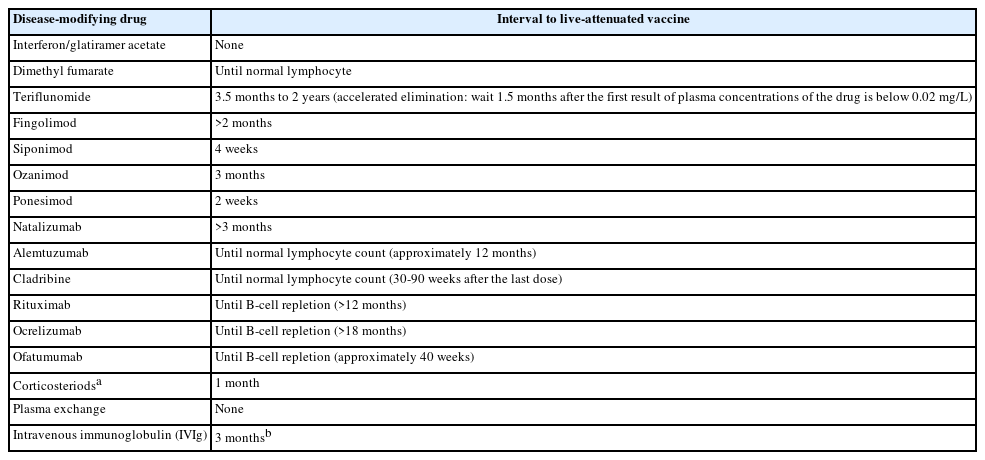
일반적으로 면역억제제를 복용하는 면역저하자에게 약독화 생백신(live attenuated vaccines)은 금기이다. 따라서, 면역억제제를 복용하는 중추신경계 탈수초성 질환 환자들에게 홍역, 풍진, 수두 등의 생백신 예방 접종 시에 특별히 주의가 필요하다. 약독화 생백신을 포함한 백신의 종류에 대해서는 Table 1에 정리하였다.
대한감염학회의 성인예방접종표에 의하면, 연령에 따라 다르지만, 기존 면역의 증거가 없는 경우 장기 이식 이외 면역억제제를 사용하는 환자는 인플루엔자, 폐렴사슬알균 백신을 접종받을 것을 권장하며, 대상포진 백신 중 생백신, 수두, 홍역-볼거리-풍진 백신 등은 생백신으로 접종을 금지하고 있다. 즉, 폐렴사슬알균 백신은 65세 이상 만성질환자, 18세 이상 장기간 스테로이드를 포함한 면역억제제를 복용하는 환자로서 이전에 폐렴사슬알균 예방 접종을 시행하지 않은 경우 13가 단백결합 백신 및 23가 다당류 백신 접종을 권장하고 있다.
일반적으로 면역억제제를 새로 시작하는 환자는 면역력이 형성되는 시기를 고려하여 불활성화 사백신은 면역억제제 시작 최소 2주 전에 접종하며, 생백신은 최소 4주 이상 전에 미리 접종하는 것을 권유한다. 백신 접종 14일 이내에 면역억제제를 복용한 경우에는 면역억제제 치료 후 재접종을 고려할 수 있다. 면역저하자에게서 백신 접종 후 형성된 혈청항체 역가를 확인하고 재접종하는 것은 일반적으로 권유하는 지침은 아니며, 혈청 내 항체검사 또한 정확한 것은 아니므로, 개별적인 고려를 요한다. 또한 생백신과 약독화 사백신은 최소 4주 이상의 간격을 두고 따로 접종하도록 권유하고 있다.
백신 접종과 관련한 면역억제제 조절
면역억제제를 복용하는 신경계 탈수초성 질환 환자들이 백신 접종 이후 증상이 악화된다는 근거는 없으며, 국민예방접종 지침에 따라 예방 접종을 시행하는 것을 권유한다. 다만 복용 중인 면역억제제의 종류에 따라 약제 용량이나 투여 시기의 조절이 필요한 경우가 있다. 면역억제제를 복용하는 경우의 백신 접종에 대해서 최근 발표된 The European Committee for Treatment and Research in Multiple Sclerosis/European Academy of Neurology (ECTRIMS/EAN)의 다발경화증 환자를 위한 백신 접종 진료 지침, Italian peripheral nervous system association 진료 지침, American College of Rheumatology Guidance (ACR) 등의 진료 지침을 참고하여 권고 사항을 정리하였다.21-23
급성기 치료 약제
부신피질호르몬제제(corticosteroids)
스테로이드 충격 요법 주사 치료가 예정된 경우 적절한 면역 반응을 위해 예방 접종을 연기할 수 있지만, 경구용 스테로이드인 프레드니손(prednisone)을 하루 20 mg 이하로 복용한 경우에는 백신 효과에 영향이 없다고 알려져 있다.24,25 이를 고려할 때 프레드니손을 하루 20 mg 이상 혹은 그와 동일 용량인 스테로이드제제를 14일 이상 사용한 경우 생백신과 관련한 안전성 문제가 발생할 수 있어, 고용량 경구용 스테로이드 복용 예정인 환자에게 생백신은 4주, 사백신은 2주 이상 전에 예방 접종을 마칠 것을 권유한다. 그러나 치사율이 높은 초기 코로나19 감염 환자들의 경우 스테로이드 치료로 인해 백신 접종을 중단하거나 연기하는 것은 권유하지 않았고 장기 스테로이드 치료 중인 환자가 코로나19 예방 접종을 받는 경우, 2차 접종 2주 후 항체 형성 여부를 모니터링을 하는 방법을 대안으로 제시한 바 있어 필요 시 다른 예방 접종에서도 이러한 방법을 차용할 수 있겠다.26
혈장교환술(plasma exchange)
디프테리아, 파상풍, 헤모필루스균, 홍역 등에 대한 항체가 혈장교환술 이후 감소하였다는 이전 연구 결과가 있었지만, 이 환자들의 장기적인 혈청 내 항체 수치에 대한 통일된 연구 결과는 없다. 하지만 혈장교환술이 혈액 내 항체 역가에 영향을 미칠 가능성이 있으므로, 가능하다면 혈장교환술 시행 이전에 필요한 백신 접종을 받을 것을 권유한다.22,27,28
면역글로블린 주사 요법(intravenous immunoglobulin G)
면역글로블린 주사 요법 후 충분한 시간을 두지 않고 예방 접종을 시행하는 경우 백신의 감염 예방 효과가 저하될 수 있다. 국내 예방 접종 진료 지침에서는 면역글로블린 정주 용량에 따라 홍역·유행성이하선염·풍진 등의 생백신은 면역글로블린 사용 3-11개월 이후 예방 접종을 시행하도록 하고 있으며, 백신을 먼저 접종한 경우 2주 이상 경과한 후에 면역글로블린을 투여하는 것을 권유하고 있다. 29 이는 백신의 종류에 따라 차이가 있어 코로나19의 경우 면역글로블린 주사 이후 8주 이상 경과하여 백신을 접종하는 것을 권장하기도 하므로 백신의 종류에 따라 접종 일정이 달라질 수 있다. 최근 ECTRIMS/EAN의 진료 지침에서는 다발경화증 환자들에게 면역글로블린 치료 후 3개월 정도 간격을 두고 백신 접종을 시행하는 것을 권하고 있다.21 덧붙여 국내에서 사용하는 경우가 많지 않으나, 면역글로블린 피하주사(subcutaneous immunoglobulin, SCIg)를 사용하는 경우에는 백신 접종 시기를 조정하는 것이 어려울 수 있다. 이전 코로나19와 관련한 외국의 진료 지침에서는 SCIg 사용 환자들은 코로나19 백신 접종 부위와 서로 다른 부위에 SCIg를 주사하도록 권고하고 있어 필요에 따라 참고하는 것을 권유한다.22
면역조절제
다발경화증 환자들에게 사용하는 면역조절제와 관련한 권고 사항은 2019년 American Academy of Neurology (AAN)에서 발표한 임상 진료 지침30 및 ECTRIMS/EAN에서 2023년 발표한 권고 사항21을 참고하였다.
면역조절제를 사용하는 환자에 대한 일반적인 권고 사항
충분한 연구가 이루어진 것은 아니지만, 다발경화증 환자들이 예방 접종으로 인해 다발경화증의 증상이 악화되거나 재발할 가능성은 낮았다. 2019년 발표된 AAN의 면역조절제를 사용하는 다발경화증 환자에 대한 예방접종 지침을 Table 2에 인용하였다. 기존의 여러 진료 지침과 2023년 새롭게 발표된 ECTRIMS/EAN의 진료 지침에서도 적절한 예방 접종을 시행하는 것이 다발경화증 환자들의 감염병을 예방하기 위해 중요하다는 것을 강조하고 있다. 예방 접종을 시행하기 전 면역억제제의 조절에 대한 임상적인 진료 지침은 Table 3에 요약하여 제시하였다. 다발경화증 환자의 면역조절제와 백신의 효과에 대한 기존 연구는 대부분 인플루엔자 예방 접종이나 B형 간염 백신 후의 접종 효과를 확인하는 것이었으며, 기존 연구 결과 인터페론 베타, 글라티라머 아세테이트, 테리플루노마이드, 디메틸 푸마레이트 등의 약제는 백신 접종 후 형성된 항체 역가에 영향을 미치지 않았다.21
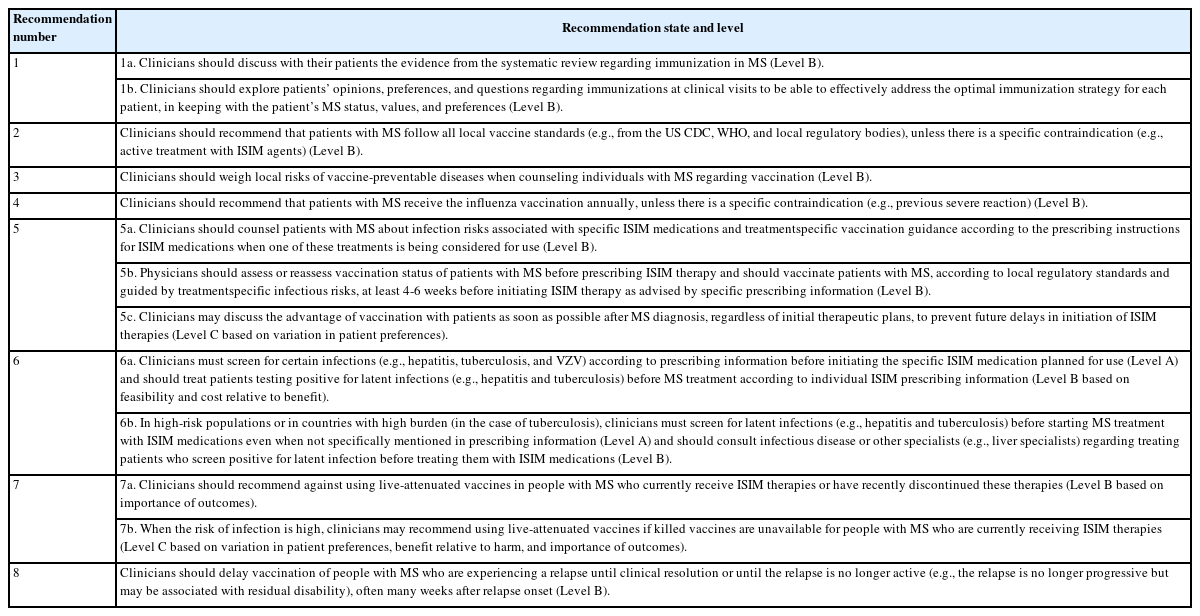
Recommendation statements for general care for individuals with multiple sclerosis when considering immunization and vaccine-preventable infections
면역억제제
리툭시맙(rituximab)을 비롯한 B세포 관련 약제
리툭시맙이나 오클레리주맙(ocrelizumab)과 같이 B세포의 억제와 관련이 있는 약제들은 다발경화증이나 시신경척수염에서 주로 사용하지만, 중증근무력증이나 만성염증성탈수초성질환 환자에게도 사용할 수 있다. 이전에 리툭시맙을 사용한 환자의 인플루엔자, 간염 백신 후의 항체 형성 연구 결과, 백신 접종 후 혈청 내 항체 형성이 감소하였다는 보고가 있었으며 최근 코로나19 예방 접종 후 항체 형성 연구에서도 오클레리주맙을 투여한 환자에게서 비슷한 결과를 보였다.31,32 따라서 B세포 관련 약제를 투여받는 환자는 백신 접종 후 항체 형성이 충분하지 않을 가능성이 있으므로 약물 사용 시기와 백신 접종에 대해 개별적인 논의가 필요하다. 기존 류마티스 진료 지침 등에서는 다음 리툭시맙 주사 일정보다 4주 이전에 백신을 접종하거나, 가능하다면 백신 접종 2-4주 이후로 다음 치료 일정을 연기하는 것을 권유하고 있다. 23,33 최근 연구에서 권유한 것처럼 2차 접종 후 항체 형성 여부를 혈청검사를 통해 확인하는 것도 백신의 효과를 확인할 수 있는 좋은 방법이라 할 수 있다.32
메토트렉세이트(methotrexate)
메토트렉세이트 복용 환자에 대한 이전 인플루엔자 백신 반응 연구 결과 메토트렉세이트가 백신 후 항체 형성을 저하시킬 수 있으므로 임상적으로 가능하다면 백신 접종 후 1-2 주 동안 약제 복용을 일시적으로 중단하는 것을 권유하고 있다.34,35
아자티오프린(azathioprine)과 마이코페놀레이트 모페틸(mycophenolate mofetil)
아자티오프린과 마이코페놀레이트 모페틸을 복용하는 환자의 경우, 대부분의 예방 접종을 특별한 처치 없이 시행할 수 있다. 그러나 아자티오프린을 하루 3 mg/kg을 초과하여 복용하는 경우 저용량을 복용할 때보다 백신에 대한 면역 반응이 저하될 수 있어 주의해야 한다. 36 또한 마이코페놀레이트의 경우 일부 진료 지침에서는 임상적으로 안정적이라면 백신 접종 후 약 1주일 동안은 약제를 중단할 것을 권유하고 있다.
사이클로포스파마이드(cyclophosphamide)
기존 ACR 진료 지침에서는 사이클로포스파마이드를 주사제로 사용하는 경우, 가능하다면 백신은 주사 휴지기에 접종하 나 백신 접종과 일주일 이상 간격을 두고 사이클로포스파마이드를 주사할 것을 권유한 바 있다.23 경구용 사이클로포스파마이드의 경우에는 따로 접종 시기의 조절이 필요하지 않다.
백신 접종 후 이상 반응과 추가 접종
백신 접종 이후 중증 이상 반응이 발생할 가능성이 높은 경우에는 백신 접종의 금기라고 할 수 있으며, 일반적으로 금기 사항에 해당되면 예방 접종을 받지 않아야 한다. 대부분의 접종 주의 사항은 일시적인 것으로, 백신 접종 후 흔히 경험하는 미열을 동반한 급성 질환, 과거 동일 백신 접종 후 경증 및 중등도의 국소 이상 반응 또는 경증 및 중등도의 발열이 있었던 경우 등은 영구적인 금기 사항이라고 할 수 없다. 백신으로 인한 중증 이상 반응은 심각한 장해를 유발할 위험이 있는 길랑바레증후군, 아나필락시스 등으로 한정되어 있어, 일반적인 경한 이상 반응은 접종 금기에 해당하지 않는다. 하지만 백신의 종류에 따라 중증 이상 반응으로 분류되는 금기 사항에 차이가 있을 수 있다. 최근 개발된 코로나19 백신의 경우, 대한내과학회 접종 지침에 따르면 첫번째 접종 시 아나필락시스와 같은 즉각적인 알레르기 반응이나 접종 후 혈전증이 있었던 경우의 동일한 백신의 두 번째 접종은 권고하지 않는다. 따라서 백신 접종 금기에 대해서는 백신 종류 별로 개별적인 판단을 필요로 한다.
덧붙여 백신 접종의 금기로 흔히 언급되는 중증 이상 반응인 길랑바레증후군의 경우, 조사 결과 길랑바레증후군 환자의 3.5%, 만성염증성탈수초성다발신경병 환자의 8%에서만 백신 접종 후 임상 증상이 악화되었다는 보고도 있으므로, 기회 감염 위험이 높은 면역저하자의 위험 대비 편익을 고려하여 백신 접종의 금기 사항을 신중히 설정해야 할 것이다.37
결론
이 글에서는 중추신경계 탈수초성질환과 백신 접종에 관련한 최신 진료 지침을 토대로 주로 사용하는 면역조절제나 면역억제제의 백신 접종과 관련한 주의 사항을 살펴보았다. 코로나19의 전 세계적인 대유행을 극복하기 위해 사상 유례없이 빠른 속도로 백신이 개발되고 감염 예방을 위한 지속적인 예방 접종이 권유되면서, 일반인의 감염병 및 백신에 대한 관심도 높아지고 있다. 신경계 질환이 아니더라도 면역억제제를 복용하는 환자들의 경우 백신 접종으로 인한 부작용을 우려하여 예방 접종을 주저하는 경향이 있었으나, 여러 연구 결과 및 최신 진료 지침을 참고할 때 다발경화증과 같은 만성적인 질환으로 쇠약한 면역저하자도 일반적인 백신 접종 진료 지침을 따르는 것을 권유하는 편이 바람직할 것이다. 최근 발표된 면역억제제 사용 환자들에 대한 백신 접종 진료 지침을 참고하여 중추신경계 탈수초성 질환 환자를 위한 효과적인 예방 접종이 시행되기를 기대한다.