자가면역 노드병증: 언제 의심하고, 어떻게 치료할까?
Autoimmune Nodopathy: When to Suspect and How to Treat?
Article information
Trans Abstract
Autoimmune nodopathy (AN) is a rare condition marked by autoantibodies that target specific proteins located within the node of Ranvier or paranodes. This disorder is distinctly different from chronic inflammatory demyelinating polyradiculoneuropathy (CIDP), with AN patients displaying unique clinical symptoms that include acute or subacute onset, primarily distal muscle weakness, sensory ataxia, tremors, and a significant increase in cerebrospinal fluid protein levels. Certain antibodies are linked to specific clinical manifestations; for instance, anti-contactin-1 neuropathy is often accompanied by nephrotic syndrome, whereas anti-pan-neurofascin neuropathy resembles fulminant Guillain-Barre syndrome. In contrast to CIDP patients, who usually experience substantial improvement with intravenous immunoglobulin (IVIG), those with AN may see poor or merely temporary benefits from IVIG therapy. Nonetheless, treatment with the anti-B cell therapy, rituximab, has shown promising results. These findings underscore the critical need for accurate identification of AN's clinical indicators, swift diagnosis of affected individuals, and the application of more effective, targeted treatments for this specific condition.
서론
자가면역 노드병증(autoimmune nodopathy, AN)은 말초신경의 랑비에노드(node of Ranvier)와 파라노드(paranode) 부위의 단백질에 대한 자가항체에 의해 유발되는 질환이다. 주요 타겟 단백질에는 파라노드에 존재하는 neurofascin-155 (NF155), contactin-1 (CNTN1), contactin-associated protein 1 (Caspr1)와 랑비에노드에 존재하는 neurofascin-186 (NF186)이 있다. 2012년 최초의 AN 사례 보고 이후, AN의 임상 양상 및 병리기전에 관한 연구들이 누적되면서, AN이 길랭바레증후군(Guillain-Barre syndrome, GBS), 만성 염증성 탈수초성 다발신경뿌리병증(chronic inflammatory demyelinating polyradiculoneuropathy, CIDP)과 같은 기존 염증성 신경병과는 구별되는 특징을 가진다는 사실이 밝혀지게 되었다. 이러한 차이점으로 인해 2021년에 개정된 CIDP 최신 가이드라인에서는 AN을 CIDP와는 다른 독립된 질환군으로 분류하고 있다.1 특히 AN의 경우, CIDP의 주요 치료법인 정맥 면역글로불린(intravenous immunoglobulin, IVIG)에 불응하거나 제한적 효과를 가지지만, 항B세포 치료제인 리툭시맙(rituximab)에 뚜렷한 호전을 보이는 경우가 많아 AN의 정확한 진단과 효과적인 치료제 선택이 중요한 임상 과제가 되고 있다. 따라서 본 종설은 신경근육질환을 다루는 신경과 의사들을 위해 두 가지 질문에 초점을 맞춰 현재까지의 지식을 정리하였다. 1) 환자가 어떤 임상 양상 혹은 검사 소견을 보일 때 AN을 의심해야 할까? 2) 만일 AN으로 진단되었다면 치료 전략을 어떻게 수립해야 할까?
본론
AN의 타겟 항원
AN의 주요 타겟 단백질은 NF155, CNTN1, CASPR1, NF186의 네 가지이며, 이들은 모두 신경세포 혹은 교세포 표면에서 세포간 부착을 돕는 역할을 한다(Fig. 1).2,3 NF155, CNTN1, NF186은 면역글로불린(imunoglobulin, Ig) 상과 superfamily에 속하며, 슈반세포에서 발현되는 NF155가 파라노드 부위 축삭에 존재하는 CNTN1-CASPR1 복합체와 결합하여 파라노드 축삭-교세포 접합을 형성한다. CNTN1은 6개의 Ig-유사 도메인, 4개의 파이브로넥틴 3형 도메인(fibronectin type-III)과 C-말단 부위(C-terminal) 글리코포스파티딜이노시톨(glycophosphatidylinositol) 막 앵커로 구성된다.4 CASPR1은 뉴렉신 상과에 속하는 190-kDa의 막경유단백질로 소포체에서 CNTN1와 복합체를 이루어 세포막으로 운반되는 것으로 여겨지고 있다.5,6 파라노드 축삭-교세포 접합은 랑비에노드에서 전압의존성소듐채널, 그리고 노드주변근접부(juxtaparanode)에서 전압의존성포타슘채널의 고농도 분포를 유지하는 데 필수적이다. 또한 NF186은 랑비에노드의 축삭에서 발현되며, gliomedin, ankyrinG, spectrin과 함께 전압의존성소듐채널의 고밀도 발현에 기여한다. 이렇듯 랑비에노드 및 주변 구조들은 신경의 활동전위 형성 및 효과적인 도약전도에 매우 중요한 역할을 수행하며, 손상 시 신경전도의 현저한 지연이나 차단을 초래할 수 있다.
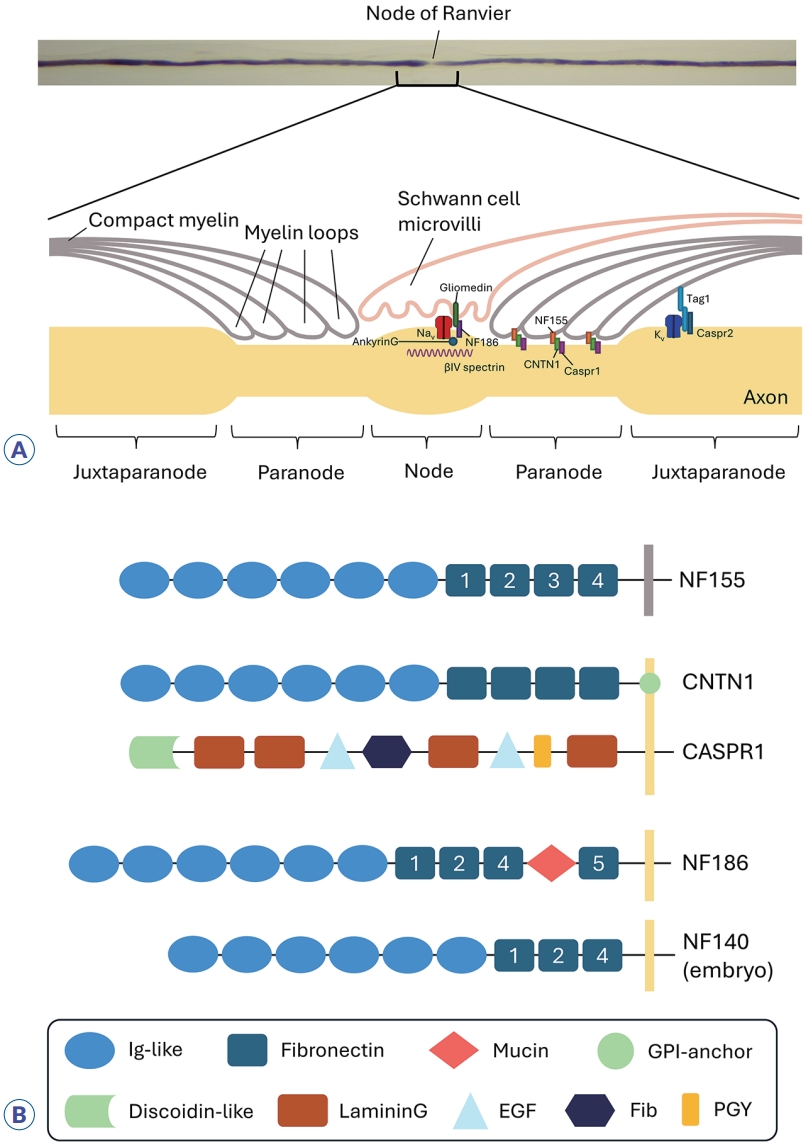
The structure of the nodes of Ranvier (A) (adapted from J Mult Scler Neuroimmunol 2022;13:23-29). And target proteins in autoimmune nodopathies (B). Ig, immunoglobulin; GPI, glycosylphosphatidylinositol; EGF, epidermal growth factor; Fib, fibrinogenlike; PGY, proline/glycine/tyrosine-rich region.
뉴로파신 유전자(Nfasc)는 선택적 스플라이싱(alternative splicing)을 통해 주로 3가지 동형(isoform) 단백질을 만든다. 성숙한 중추 및 말초신경계에서는 NF155와 NF186이 발현되며, NF140은 배아기 신경세포에서 발현된다.7 이 동형 단백질들의 세포 외 부분은 공통적으로 막경유(transmembrane) 도메인, 3-4개의 파이브로넥틴(fibronectin, FN) III도메인, 6개의 면역글로불린(Ig) 도메인으로 구성된다. 각 동형 단백질마다 구성하는 파이브로넥틴의 종류와 수가 서로 다르며, NF186은 뮤신(mucin) 도메인을 추가적으로 가지고 있다. 자가항체가 NF155에 특이적으로 결합하는 경우가 가장 흔한 AN의 형태인데 이때 FN3-FN4 부분이 항원결정기(epitope)로 여겨진다.8 자가항체가 모든 뉴로파신 동형 단백질들에 결합하는 경우는 항pan-NF 항체라고 부르며, 6개의 Ig 부분이 항원결정기이다.9 항pan-NF 항체와 달리 자가항체가 NF140/186에 특이적으로 결합하는 사례도 보고된 적이 있으나, 이러한 사례는 극히 드물어 아직 질병의 특성이 온전히 규명되어 있지 않다.10,11
AN의 역학
랑비에노드와 파라노드에 대한 자가항체가 발견된 이후, GBS와 CIDP 같은 염증성 신경병 환자군 내에서 AN의 유병률을 조사한 연구가 다수 이루어졌다. 특히 AN 중에서 가장 높은 유병률을 보이는 항NF155 신경병 관련 10개의 연구를 종합한 메타분석에 따르면, CIDP 코호트 내 AN의 통합 민감도(pooled sensitivity)를 9% (95% 신뢰구간, 6-15%)로 보고하였다.12
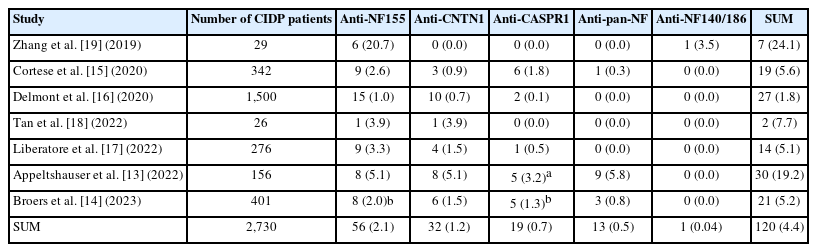
Table 1은 CIDP 환자군을 대상으로 4가지 AN 항체를 모두 검사하여 유병률을 분석한 7개의 연구를 요약한 것이다.13-19 연구들은 최소 26명에서 최대 1,500명의 CIDP 환자를 모집했으며, 총 2,730명 중에서 56명(2.1%)이 항NF155 신경병, 32명(1.2%)이 항CNTN1 신경병, 19명(0.7%)이 항CASPR1 신경병, 13명(0.5%)이 항pan-NF 신경병을 보였다. 더불어 드문 사례로, 항NF155 및 항CASPR1이 모두 양성인 환자, 항NF155에는 음성이면서 항NF140/186에만 특이적인 양성 반응을 보인 경우도 각 1건씩(0.04%) 보고되었다. 대부분의 연구에서 AN 내에서 자가항체 유형별 상대빈도는 항NF155, 항CNTN1, 항CASPR1, 항pan-NF 신경병 순서였으며, 항NF155 신경병이 전체 AN의 약 절반을 차지하였다(46.7%). CIDP로 진단된 환자군 내에서 AN의 총 유병률은 1.8%에서 24.1%로 매우 다양하였으며, 통합 민감도는 4.4%로 나타났다. 유병률이 연구에 따라 편차가 큰 이유로는 후향적 코호트에 기반한 연구의 선택 비뚤림(selection bias) 위험, 항체 검출 방법의 성능 차이, 지역적/인종적 편차 등이 이유가 될 수 있다. 또한 AN에서 자가항체 역가는 면역 치료 및 질병 활성도에 따라 달라질 수 있어,20-24 채혈 시점에 따라 양성률이 과소평가되었을 가능성도 배제할 수 없다. 따라서 AN의 역학을 정확히 파악하기 위해서는 일관된 항체 검출 프로토콜과 전향적으로 계획된 다기관 대규모 코호트 연구가 필요하다.
AN의 임상 양상과 검사 소견
AN 환자들은 자가항체의 유형과 관계없이 공통적인 임상 양상을 나타내는 경우가 많은데(Fig. 2), 이는 AN의 자가항체들이 대체로 파라노드 축삭-교세포 접합(paranodal axo-glial junction) 부위를 표적한다는 사실로 이해해 볼 수 있다. 임상적으로는 AN 환자들은 급성 혹은 아급성으로 발병하는 경향이 있으며,1 원위부 침범의 위약감이 많이 나타나고, 감각실조증이나 저빈도/고진폭의 손떨림이 흔하다. 특히 혈청음성 CIDP 환자들에 비해 호흡부전이나 뇌신경 침범이 더 자주 관찰될 뿐 아니라, 뇌척수액 내 단백질의 더욱 현저한 상승이 특징적이다. 그중에서도 가장 주목할 만한 점은 대다수의 AN 환자가 CIDP의 표준 치료법인 IVIG에 제한적이거나 일시적인 반응을 보인다는 점이다. 따라서 AN의 가능성이 있는 환자를 임상적으로 의심하여 정확히 진단하고 보다 적합한 치료 전략을 수립하는 것이 보다 중요하다.
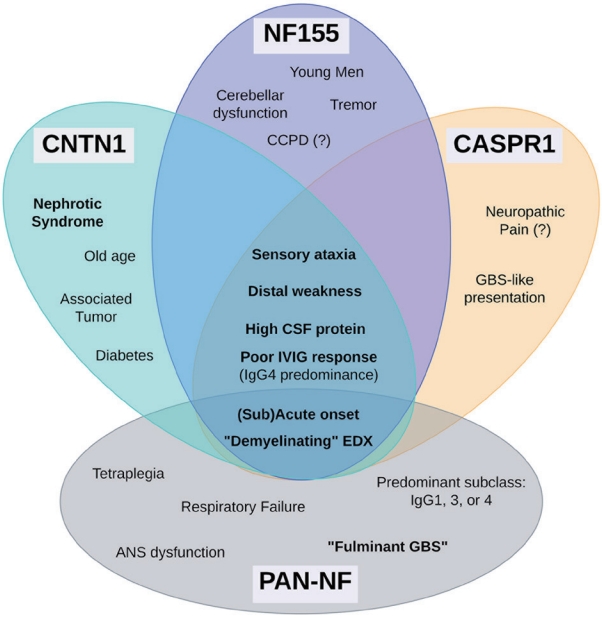
Common clinical features and antibody-specific characteristics of autoimmune nodopathies. CCPD, combined central and peripheral demyelination; CSF, cerebrospinal fluid; IVIG, improvement with intravenous immunoglobulin; IgG4, immunoglobulin G4; EDX, electrodiagnosis; GBS, Guillain-Barre syndrome; ANS, autonomic nervous system; Pan-NF, panneurofascin-140/186.
AN은 병리학적으로 분절 탈수초(segmental demyelination)를 일으키지 않음에도 불구하고, 신경전도검사 결과는 CIDP에서 관찰되는 모든 탈수초 의심 소견을 재현할 수 있다.25 그중에서도 특히 원위부 운동 잠복기(distal motor latency)의 연장이나 F파 연장, 상지 운동신경전도 속도의 감소가 두드러지게 나타나며, 혈청음성 CIDP에 비해 상지 감각신경의 활동전위 진폭이 낮다는 보고가 있다.26 그럼에도 불구하고 AN 환자의 전기생리학적 특징과 관련해서는 추가적인 연구가 요구된다. 특히 축삭-교세포 접합이 타겟인 AN과 랑비에노드와 파라노드가 모두 공격받는 항pan-NF 신경병 간의 차이점이 있는지, 종적인 (longitudinal) 전기생리학적 변화의 관점에서 AN과 CIDP 간에 구분되는 패턴이 있는지 보다 심도 깊은 연구가 필요하다.27,28
한 독일 그룹의 연구 결과에 따르면, AN 환자의 당뇨병 유병률(33.3%)은 일반 독일 인구(9.9%)나 혈청음성 CIDP 환자군(15.1%)에 비해 상당히 높고, 당화혈색소(HbA1c) 수치는 자가 항체 역가와 양의 상관관계를 보인다.13 이와 같은 현상은 당뇨병으로 인해 손상된 혈액-신경장벽(blood-nerve bvarrier)을 통해 말초신경 구성 물질이 혈중으로 유출되어 자가면역 반응을 유발할 수 있다는 가설로 설명하고 있다. 특히, 당뇨병의 유병률은 AN 중 비교적 고령에서 발병하는 항CNTN1 신경병에서 특히 높은 것으로 알려져 있다. 따라서, 당뇨병 환자에서 탈수초성 병변이 확인되는 경우, 당뇨병성 신경병과 병발된 CIDP를 감별하는 것뿐만 아니라, 여전히 AN을 시사하는 증상이나 징후가 있는지도 면밀히 검토할 필요가 있겠다.
항체-특이적 임상 양상
위에 기술한 AN의 임상 양상은 대부분의 경우 타겟 항원과 무관하게 나타나는 공통적인 특징을 정리한 것이다. 이외에도, AN 내에서 각 자가항체와 고유하게 연관되어 있는 임상적인 특징들도 관찰된다. 각 타겟 항원에 따라 항체-특이적 임상 양상을 호발순으로 정리하고자 한다(Fig. 2).
항NF155 신경병의 경우, 주로 젊은 연령대(20-30대)의 남 에게서 호발하는 경향이 있으며, AN에서 비교적 드물게 나타나는 소뇌실조증도 주로 항NF155 항체와 관련이 있다.8,22,29-31 일본에서 실시된 전국적 연구(nationwide study)에 따르면, 복합 중추 및 말초신경계 탈수초질환(combined central and peripheral demyelination, CCPD) 환자의 약 45.5% (5/11)에서 항NF155 항체가 검출되었다.32 반면, 이탈리아와 프랑스에서 진행된 연구에서는 16명의 CCPD 환자 중 항NF155항체는 검출되지 않았다(0%).33 이는 CCPD를 포함한 AN의 임상적 발현 패턴에 지역적 혹은 인종적 차이가 존재할 수도 있음을 시사한다.
항CNTN1 신경병은 절반 이상의 환자에서 신증후군이 동반되는 것이 특징적이며, 이러한 임상적 발현은 신경-신장증후군(neurorenal syndrome)으로 불린다.23,34 항CNTN1 신경병 환자의 신장조직검사에서는 막성 사구체신염(membranous glomerulonephritis) 및 사구체모세혈관벽에 면역글로불린의 침착이 관찰되며, 신증후군의 주요 원인 중 하나인 항포스포리파아제2 수용체(anti-phophoLipase A2 receptor) 항체는 검출되지 않는다. 이는 CNTN1 단백질이 신장 사구체에서도 발현되는 것과 연관이 있을 수 있다. 그 뿐만 아니라, 일부 항CNTN1 신경병 환자는 만성 면역 감각 다발뿌리병증(chronic immune sensory polyradiculopathy)이나 부종양성 증후군(paraneoplastic syndrome)의 형태로 나타나거나, 단클론성 감마병증(monoclonal gammopathy)과 함께 발생하는 경우도 있어, 항CNTN1 신경병 진단 시 동반된 종양의 존재 등에 대한 주의가 필요하다.35
항CASPR1 항체는 신경병성 통증이 두드러진 환자 2명에서 처음 발견되었기 때문에, 초기에는 항CASPR1 신경병과 신경병성 통증 사이의 연관성이 주목받기 시작하였다.36 하지만 이후 뒤따른 연구에선 신경병성 통증을 동반하지 않는 사례도 다수 확인되면서, 항CASPR1항체와 신경병성 통증 간의 관련성에 대한 추가적인 임상적 및 기전적 근거가 뒷받침되어야 할 것으로 보인다.15,37 항CASPR1 신경병은 GBS와 같은 급성 발병이 항pan-NF 신경병에 이어 두 번째로 흔한데, 이러한 급성 발병에는 IgG3 아이소타입이 연관되어 있다는 보고도 있다.36,38
항pan-NF 신경병은 다른 세 가지의 AN 질환과는 구별되는 독특한 임상 양상과 검사 소견을 보인다.39,40 모든 뉴로파신 동형 단백질, 특히 NF155와 NF186를 공격하는 항pan-NF 신경병은 전격성(fulminant) GBS의 형태로 나타나는 것이 특징이다. 대다수 환자에서 심각한 사지마비(tetraplegia)가 발생하여 보행이 불가능하며, 기계호흡을 요하는 호흡부전이 동반되고, 약 절반은 잠김증후군(locked-in syndrome)으로 진행된다. 다른 AN 유형에서 주로 보이는 IgG4 아이소타입과는 달리, 항pan-NF 신경병에서는 IgG1 또는 IgG3가 주된 아이소타입으로 관찰되기도 한다.39,40 또한, 다른 AN 유형과는 달리 뇌척수액 단백질 수치의 현저한 증가가 관찰되지 않으며, 뇌신경 침범 및 자율신경부전이 자주 동반되는데, 이러한 특징적인 임상 양상의 기전에 대해서는 추가적인 연구가 필요하다. 항CNTN1 신경병과 유사하게, 항pan-NF 신경병 환자에서도 신증후군이 종종 보고되는데, 이는 NF186 항원이 신장 사구체에서 발현될 수 있기 때문으로 추정된다.41
AN의 치료
AN을 GBS 및 CIDP와 별개의 질환으로 명확히 구분하게 된 주된 이유 중 하나가 면역 치료제에 대한 반응 패턴의 차이 때문이다. 특히 GBS와 CIDP에 대한 일차 치료제인 IVIG에 대해 AN 환자들은 반응이 없거나 일시적인 호전에 그치는 경향이 있으며, 이는 AN 자가항체 중 주로 IgG4 아이소타입이 관여하기 때문으로 해석된다.
IVIG는 자가항체의 Fc 부분에 의해 매개되는 면역 반응을 억제하는 역할을 한다. 이는 C1q를 통한 고전적 보체 경로(classical complement pathway)의 활성화로 의한 보체매개독성(complement-dependent cytotoxicity), 백혈구의 침윤을 통한 항체매개 세포독성(antibody-dependent cellular cytotoxicity) 및 식세포작용(phagocytosis), 그리고 염증성 조직 손상 등의 기전을 포함한다.42,43 그러나 IgG4 항체는 단일 아미노산 치환(P331S)과 같은 구조적 변화로 인해 Fc 매개 면역 반응을 일으키지 않는다. 또한 IgG4는 주로 Fab팔교환(Fabarm exchange) 현상으로 인한 단가-양측특이성(monovalent bispecific) 특성을 가지고 있기 때문에 세포 표면 항원과의 교차결합(cross-link) 및 내면화(internalization)를 유도하지 못한다.42,44 그 대신, 항체의 Fab 부분이 항원과 결합함으로써 세포 간 부착, 신호 전달, 수용체 및 효소 작용 등 단백질 간 상호작용을 억제하는 방식으로 작용한다.15,42 IgG4 항체의 이러한 독특한 면역학적 특성으로 인해 IgG4 매개 자가면역질환은 IVIG 치료에 제한적인 반응을 보인다. 일부 환자에서 IVIG 치료 후 관찰되는 일시적인 호전은 질병의 급성기에 종종 검출되는 IgG1-3 항체에 대한 면역학적 효과 때문일 가능성이 있다.38
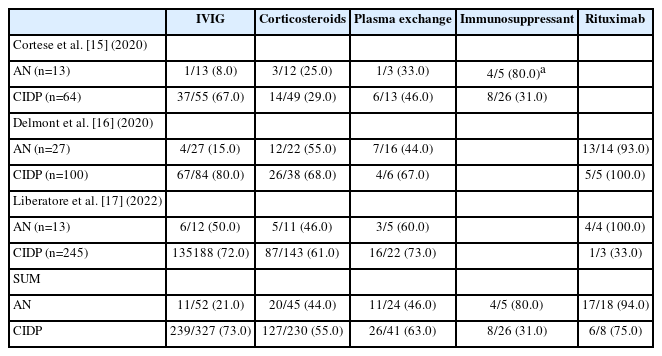
Table 2는 IgG4 항체 양성 AN 환자의 면역 치료제 반응을 혈청 음성 CIDP 환자와 비교한 3개의 연구를 정리한 내용이다.15-17 근거 수준을 고려하여, AN 사례 혹은 사례군을 단독 보고한 연구는 제외하고, AN 및 CIDP 환자군을 직접 비교한 연구 결과만을 포함하였다. 보고된 결과에 따르면 IVIG는 CIDP 환자들에게는 상당히 효과적인 치료 옵션으로 나타났으나(73.1%), AN 환자에게는 치료 효과가 좋지 않았다(21.2%). 스테로이드나 혈장교환술의 경우 CIDP(스테로이드, 55.2%; 혈장교환술, 63.4%)에 비해 AN 환자(스테로이드, 44.4%; 혈장교환술, 45.8%)에서 치료 성적이 불량했지만, IVIG보다는 다소 나은 치료적 대안으로 생각된다. 특히 리툭시맙은 18명의 AN 환자 중 17명이 뚜렷한 호전을 보여(94.4%), 면역 치료에 반응하지 않는 AN 환자들에게 효과적인 치료 옵션으로 여겨진다. 하지만 이 데이터는 후향적인 보고, 치료 용량 및 기간의 다양성 그리고 서로 다른 성과 지표(outcome measure)의 사용 등으로 인해 확실한 결론을 도출하는 데 한계가 있기 때문에 대규모 전향적 관찰 연구가 필요하다. 약제 임상시험으로는 현재 치료 불응성 AN 환자에서 리툭시맙의 효과와 안전성을 평가하기 위한 무작위 대조 임상시험(RECIPE trial, NCT03864185)이 일본에서 진행 중에 있다.45 국내에서는 리툭시맙의 사용이 투약 방법, 안전성, 비용 등의 문제로 인해 제한적이기 때문에, AN 환자의 일차 치료로 스테로이드나 경구 면역 억제제와 같은 대안의 유효성을 검토할 필요가 있겠다. 더 나아가 다기관 연구를 통해 AN 환자의 국내 치료 데이터 상황을 공유하고 치료 알고리즘 정리, 효과적 약제의 보험/급여화 시도를 해보는 다양한 노력이 요구되겠다.
결론
자가면역 노드병증(AN)은 말초신경의 랑비에노드 또는 파라노드 부위의 단백질을 공격하는 자가항체에 의해 발생하는 비교적 드문 질환이다. AN 환자들은 CIDP와 구별되는 고유한 임상 양상을 보이는데, 이는 급성 또는 아급성의 발병 양상, 주로 원위부에 나타나는 근력 약화, 감각실조증, 손떨림, 뇌척수액 내 단백질의 현저한 증가 등이 포함된다. 특히 항CNTN1 신경병의 경우 신증후군이 흔히 동반되며, 항pan-NF 신경병은 전격성 GBS와 유사한 양상으로 나타나는 등 각 항체별로 특이적인 임상 양상을 보이기도 한다. 일반적으로 AN 환자들은 CIDP의 표준 치료법인 정맥 면역글로불린(IVIG)에 반응이 불량한 반면, 항B세포 치료제인 리툭시맙에는 뚜렷한 호전을 보일 수 있다. 따라서, AN의 특징적인 임상 양상을 잘 숙지하고, 해당 증상이 있는 환자에서 적극적으로 의심하며, 진단 시 효과적인 치료 옵션을 선택하는 것이 중요하다.