다발성경화증에서의 다차원적 장애 평가 척도
Disability Measurement in Multiple Sclerosis: Beyond EDSS
Article information
Trans Abstract
Multiple sclerosis (MS) is a chronic inflammatory disorder of the central nervous system in which relapses and neurodegeneration lead to cumulative neurological decline. Historically, therapeutic development in MS has focused on relapse prevention, while disability progression has been evaluated using the Expanded Disability Status Scale (EDSS). However, EDSS is heavily weighted toward ambulation, and thus lacks sensitivity to less noticeable motor changes such as upper-limb dysfunction, and cognitive changes. Recently, the growing recognition that MS can progress independent of relapse activity has underscored the need for more precise, multidimensional assessment tools capable of capturing the full spectrum of MS-related impairment. Recent advances have introduced performance-based measures and composite functional outcomes integrating domains of ambulation, manual dexterity, cognition, and vision. These quantitative assessments provide objective and reproducible metrics of function and can detect subclinical progression earlier than conventional scales. As the focus of MS management shifts from relapse control to prevention of long-term disability, multidimensional functional assessment offers a practical and comprehensive approach for both clinical and research settings, with the potential to refine therapeutic decisions and improve patient outcomes.
서론
다발성경화증(multiple sclerosis, MS)은 임상적 재발과 점진적 신경 퇴행이 복합적으로 작용하여 신경학적 장애가 누적되는 염증성 중추신경계 질환이다. 주로 젊은 성인기에 발병하여 환자와 가족은 물론 사회적·경제적 측면에서도 상당한 부담을 초래하므로,1,2 치료의 궁극적인 목표는 장기적인 신경학적 장애의 누적을 최소화하거나 예방하는 것이다.2
지난 수십 년간 다양한 질병 조절 치료제(disease-modifying therapy)가 개발되었으며 이들 치료제는 주로 연간재발률(annualized relapse rate) 감소 효과를 중심으로 평가되어 왔다.3 그러나 고효능 질병 조절 치료제의 도입으로 재발이 효과적으로 억제되고 임상적으로 안정되었다고 평가된 환자에서도 시간이 지남에 따라 서서히 장애가 누적되는 현상이 관찰되었고,4,5 이는 재발과 무관한 장애 진행(progression independent of relapse activity, PIRA)이라는 개념 정립으로 이어졌다.5,6 PIRA는 재발 관련 악화(relapse-associated worsening)와 함께 다발성경화증 장애 축적의 주요 기전임이 밝혀졌으나,5,7 기존에 사용하던 표준 장애 평가 척도인 Expanded Disability Status Scale (EDSS)만으로는 미세한 질병 상태의 변화를 민감하게 반영하지 못한다는 제한점이 제기되었다.
장애 진행을 평가하는 도구의 민감도가 낮으면 질환의 진행을 조기에 파악하고 치료 전략을 조정하는데 제약이 될 뿐 아니라, 임상 시험에서도 약제 효과의 통계적 유의성을 입증하기 위해 더 많은 환자 모집과 장기 추적을 필요하게 만들어 임상 시험의 실현 가능성과 비용 효율성을 저하시킨다.8 이에 따라 최근에는 새로운 영상학적 지표(radiologic biomarkers), 체액 바이오마커(fluid biomarkers), 환자 보고 결과(patient-reported outcomes) 등 다양한 측면에서 질환의 진행을 종합적으로 평가하려는 시도가 이루어지고 있다. 이와 더불어 재발 억제 중심의 치료 패러다임에서 벗어나 장애 진행 그 자체를 정밀하게 포착할 수 있는 다차원적 기능 평가 도구의 필요성이 대두되었다.
본 종설에서는 다발성경화증의 표준 장애 평가 척도인 EDSS의 특성과 한계를 고찰하고 이를 보완하기 위해 개발된 복합 척도의 발전 과정과 이를 구성하는 주요 수행 검사(performance test)의 임상적 의의를 논의하고자 한다.
본론
EDSS
Kurtzke9가 1955년 제안한 Disability Status Scale은 1983년 EDSS로 개정되어 현재까지 다발성경화증 환자의 임상 시험과 진료 현장에서 표준 장애 평가 척도로 활용되고 있다. EDSS는 신경계 진찰 소견을 기반으로 한 functional system score (FSS)와 보행 기능을 종합하여 0(정상)에서 10(다발성경화증 관련 사망)에 이르는 순서 척도(ordinal scale)로 산정된다.9 EDSS 4.0 미만 구간에서는 FSS의 조합으로 점수가 산정되며 4.0-7.0 구간에서는 보행 가능 거리와 보조기구의 사용 여부가 주요 평가 기준이 된다. EDSS 7.5 이상에서는 보행이 불가능한 환자의 일상생활 수행 능력이 중심이 된다.
EDSS는 오랜 기간 표준 척도로 사용되어 왔으나 다음과 같은 주요 제한점들이 지속적으로 제기되었다. 첫째, EDSS는 평가자 간 변동성(inter-rater variability)을 보인다. 이러한 경향은 EDSS 5.5 미만의 낮은 점수 구간에서 두드러지며 특히 감각 및 인지 계통 평가의 일관성이 낮은 것으로 보고되었다.10,11 이러한 평가자 간 불일치는 EDSS의 신뢰도(reliability)를 저하시키는 요인이 된다.
둘째, 변화에 대한 민감도가 낮다.12 낮은 점수 구간에서는 비교적 작은 증상의 변화도 점수 변동으로 이어질 수 있는 반면 EDSS 4.0 이상에서는 FSS 변화가 EDSS에 충분히 반영되지 않는다.12,13 예를 들어 EDSS 6.5인 환자는 하지 근력저하가 새로 발생하더라도 EDSS 점수는 변하지 않을 수 있다. 반대로 경미한 보행 장애가 있더라도 500 m 이상 독립적으로 걷는다면 보행 거리의 세부 변화가 반영되지 않아 보행 능력을 정량적으로 평가하기 어렵다.14
셋째, EDSS는 보행 중심의 평가 체계로 설계되어 있어 시각, 상지 기능, 인지, 피로, 기분 증상 등 다양한 신경계 증상 및 징후를 충분히 포괄하지 못한다. 이로 인해 실제 환자가 겪는 일상생활 수행 능력 저하나 삶의 질 저하가 과소평가될 수 있다.15,16
마지막으로, EDSS는 선형 척도가 아니므로 1점 상승이 각 단계마다 갖는 의미가 동일하지 않으며 각 점수 구간에 머무는 시간도 일정하지 않다. 실제로 EDSS 4.0에서 6.0으로 진행하는 시간이 0-3 또는 6-8 구간보다 더 빠른 경향을 보여,17,18 EDSS는 3.0과 6.0 부근에서 빈도가 높은 이항 분포(bimodal distribution)를 나타낸다.18,19 이런 특성 때문에 모수적 통계 분석에는 적합하지 않다는 지적도 있다.18
이러한 비선형성이나 민감도 차이를 보정하기 위해 임상적으로 유의한 악화(clinically meaningful worsening)는 기저(baseline) EDSS 점수에 따라 다르게 정의된다. 문헌에 따라 차이가 있지만 가장 통용되는 기준은 다음과 같다.6
Baseline EDSS=0: 1.5점 이상 증가. Baseline EDSS=1.0-5.5: 1점 이상 증가. Baseline EDSS ≥6.0: 0.5점 이상 증가.
또한 환자의 기능은 일시적 변동성을 보일 수 있으므로 EDSS 점수의 증가가 일정 기간(예: 3개월 또는 6개월) 이상 지속되어 추적 평가에서 재확인되면 이를 confirmed disability progression (CDP)로 정의한다.20
명확한 제한점과 후술할 다양한 수행 검사 도구의 도입에도 불구하고 EDSS는 여전히 대체 불가능한 핵심 지표로 자리하고 있다. 수십 년에 걸친 임상적 검증과 광범위한 적용을 통해 그 신뢰성과 재현성이 입증되었으며 연구자와 규제기관 모두에게 익숙한 공통 언어로 기능하기 때문이다. 무엇보다 동일한 척도를 기반으로 장기간 축적된 임상 시험 결과를 비교·연결할 수 있다는 점에서 EDSS는 독보적인 장점을 지닌다.
MS functional composite (MSFC)의 개발
MSFC는 EDSS의 한계점을 보완하고 임상 시험에서 활용 가능한 객관적이고 정량적이며 다차원적인 장애 평가 도구를 마련하기 위해 1999년 미국다발성경화증학회(National Multiple Sclerosis Society) 산하 Clinical Outcomes Assessment Task Force에 의해 개발되었다.15
개발 연구진은 보행 기능, 상지 기능, 인지 기능을 세 가지 핵심 항목으로 설정하고 다양한 수행 검사들의 임상적 연관성, 신뢰도, 시간에 따른 변화 감지 능력 등을 종합적으로 검토하여 세 가지 도구를 선정하였다. 1) 보행 기능: timed 25-foot walk (T25FW). 2) 상지 기능: 9-hole peg test (9HPT). 3) 인지 기능: paced auditory serial addition test (PASAT).
각 검사의 결과는 성별과 연령에 대한 참조 값을 기준으로 표준화된 Z점수로 변환되며 세 항목의 Z점수를 평균하여 통합 MSFC 점수를 산출한다(각 검사에 대한 자세한 내용은 후술한다). MSFC 점수는 연속형 척도로 구성되어 통계 분석에 용이하며 재현성이 높다.15 MSFC는 EDSS 및 삶의 질 척도와 높은 상관관계를 보였으며,13,21 초기 MSFC 변화가 향후 EDSS 악화를 예측할 수 있다는 결과를 통해 예측 타당도 또한 입증되었다.15,16,22,23
그럼에도 불구하고 MSFC는 임상 시험의 1차 평가변수로 널리 채택되지는 못하였는데 Z점수를 기반으로 계산되는 특성상 환자의 임상 상태를 직관적으로 파악하기 어려웠기 때문이다.24 또한 Z점수는 기준 집단에 따라 값이 달라져 연구 간 비교가 어렵고,24,25 임상적으로 유의한 악화의 정의가 표준화되어 있지 않아 1차 평가변수로 활용하기에는 제약이 따랐다.3
구성 요소 중 하나인 PASAT의 실용성 문제도 제기되었다. PASAT는 3초 간격으로 제시되는 60개의 숫자를 들으면서 순차적으로 더해가는 검사로 수학 연산 능력과 청각 집중력을 요한다. 이 과정에서 환자에게 피로감과 스트레스를 유발해 순응도가 떨어지며 반복 검사 시 뚜렷한 학습 효과가 나타나는 단점이 있었다. 이에 Drake et al.26의 연구를 시작으로 다수의 연구에서 PASAT 대신 시각적 정보처리 검사인 symbol digit modalities test (SDMT)를 적용한 MSFC를 검증하였다. 그 결과 SDMT 기반의 MSFC는 PASAT 기반의 MSFC와 동등한 신뢰도를 보이면서도 질병 경과 및 직업 기능 저하에 대한 예측력이 더 우수한 것으로 보고되었다.26-28
MS outcome assessments consortium (MSOAC)의 설립
MSOAC는 환자 단체, 규제기관(미국 식품의약국, 유럽 의약품청), 학계 및 산업계가 공동으로 참여하는 협의체로 임상 시험에서 장애를 민감하게 평가할 지표를 개발하고 이를 규제기관이 승인하는 표준 도구로 발전시키기 위해 2012년에 설립되었다.29
MSOAC는 MSFC의 구성 요소를 기반으로 하되 장애를 구성하는 핵심 영역을 시각기능을 더하여 네 가지로 확장하였다. 체계적 문헌고찰을 통해 각 영역을 대표할 수행 검사를 검토한 결과,29-33 보행과 상지기능은 기존의 T25FW, 9HPT가 유지되었다. 인지 평가 도구로는 PASAT보다 SDMT가 더 적합하다는 합의에 도달하였고,31 시각기능 평가를 위해 low-contrast letter acuity (LCLA)가 새로 선정되었다.32
이후 MSOAC는 14개의 다국적 임상 시험에 참여한 12,776명 환자 데이터를 통합 분석하여 네 가지 수행 검사(T25FW, 9HPT, SDMT, LCLA)의 민감도, 타당도 및 임상적 유의성을 검증하였고 EDSS 및 환자 보고형 삶의 질 척도, 우울 척도 등과의 상관성을 평가하였다.34 분석 결과 네 검사 모두 높은 재현성과 타당도, 민감도를 나타냈다. T25FW와 9HPT는 서로 강한 상관관계를 보였으며 EDSS와도 유의한 연관성을 보여 신체적 장애를 잘 반영하는 것으로 확인되었다. 반면 SDMT와 LCLA는 EDSS와 비교적 약한 상관관계를 보였는데 이는 EDSS 만으로 포착되지 않는 영역을 보완적으로 평가할 수 있음을 시사하였다.
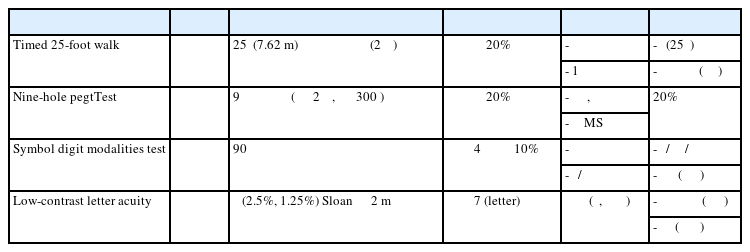
또한 네 가지 수행 검사 중 하나라도 악화를 보인 환자의 비율이 EDSS 악화를 보인 환자 비율보다 높게 나타나 복합 기능 평가가 단일 EDSS 평가보다 장애 진행을 보다 민감하게 탐지할 수 있음을 확인하였다.34 이 결과를 바탕으로 네 가지 수행 검사는 단독 또는 복합 평가변수로 활용될 수 있는 근거가 마련되었다. 이하에서는 MSOAC에서 검증된 네 가지 핵심 수행 검사에 대해 개별적으로 살펴보고자 한다. 주요 내용은 Table 1에 요약하였다.
T25FW
하지 기능과 보행 속도를 정량적으로 평가하는 검사로 신뢰도, 타당도가 높으며,33,35 다발성경화증 환자의 보행 능력 변화를 모니터링하기 위해 임상과 연구에서 널리 활용되고 있다.33 검사 절차는 다음과 같다. 피검자가 장애물이 없는 25피트(7.62 m) 직선 구간을 걷는데 걸리는 시간을 초 단위로 측정한다. 가능한 한 빠르고 안전하게 걷도록 지시하며 피검자의 발이 출발선에서 지면을 떠나는 순간부터 도착선을 완전히 통과할 때까지의 시간을 기록한다. 이때 피검자가 도착선 앞에서 속도를 줄이지 않도록 도착선을 지난 후에 멈추도록 지시해야 한다. 동일 조건에서 두 차례 시행하여 평균값을 최종 결과로 사용한다. 평소 사용하는 보행 보조기를 사용할 수 있으며, 검사 중 넘어질 경우 재시행하되 두 번 연속 실패하면 검사를 중단한다.
기저 결과 대비 소요 시간이 20% 이상 증가할 경우 임상적으로 유의한 악화로 간주하며 25FWT 악화는 삶의 질 저하와 잘 연관된다.33 특별한 도구가 필요하지 않고 단시간(1분 이내) 내 시행 가능하여 현실적이다. 다만 피로도나 보행 보조기구의 변경과 같은 외부 요인이 결과에 영향을 미칠 수 있으며 보행 장애가 경미한 환자에서는 천장 효과로 인해 이상을 탐지하기 어렵고, 보행이 불가능한 환자에게는 적용이 불가능하다.36 보행 속도만을 측정하므로 보행의 질, 균형, 지구력 등은 반영하지 못한다는 점도 고려해야 한다.
9HPT
상지 기능과 손의 협응 능력을 정량적으로 평가하는 검사로 평가자 간 및 평가자 내 신뢰도가 높고 일상생활 수행 능력과의 연관성이 입증되어 임상 및 연구 모두에서 손의 기민성을 평가하는 표준 도구로 활용되고 있다.30,37 검사 절차는 다음과 같다. 피검자가 한 손으로 9개의 핀(peg)을 9개의 구멍이 있는 판에 모두 꽂은 뒤 다시 모든 핀을 하나씩 빼서 용기에 넣는 데 걸리는 시간을 초 단위로 측정한다. 피검자에게 가능한 한 빠르게 수행하도록 지시하며 좌·우 손 각각 2회씩(총 4회) 시행하여 각 손의 평균값을 구한다. 우세 손(dominant hand)이 비우세 손(non-dominant hand)에 비해 유의하게 빠른 수행 속도를 보이므로 양손의 결과는 별도로 보고하는 것이 권장된다. 제한 시간은 시도당 300초이며 시간 내 완료하지 못한 경우 수행한 핀의 개수를 기준으로 초당 수행 속도(pegs/second)를 산출한다. 검사 중 핀이 바닥에 떨어지면 검사자가 주워서 용기에 담고 책상 위에 떨어지면 피검자가 스스로 주워서 수행을 지속한다.
기저 결과 대비 수행 시간이 20% 이상 증가한 경우를 임상적으로 유의한 변화로 간주한다. 9HPT 악화는 장기적인 장애 축적과 밀접한 관련이 있으며 특히 진행형 다발성경화증(progressive MS)에서 장애 진행을 민감하게 탐지하는 것으로 보고되었다.38,39 소요 시간이 짧고 절차가 간단하며 환자의 순응도가 높다는 장점이 있다. 그러나 관절 질환이나 통증 등 근골격계 요인이 결과에 영향을 줄 수 있다. 그리고 20%라는 변화 기준이 다발성경화증의 모든 질병 단계에 동일하게 적용될 수 있는지에 대해 추가적인 검증이 필요하다는 지적도 있다.30
SDMT
인지 처리 속도와 주의 집중 기능을 평가하는 검사로 다발성경화증 환자에서 흔히 나타나는 정보 처리 속도 저하를 평가할 수 있다.40,41 검사의 신뢰도와 타당도가 높아,31,41 미국다발성 경화증학회에서는 SDMT를 임상진료에서 권장되는 표준 인지 평가 도구로 권고하였다.40 검사 절차는 다음과 같다. 검사지 상단에 1부터 9까지의 숫자와 이에 대응하는 기호(symbol)가 짝지어진 대응표가 제시된다. 피검자는 주어진 기호에 해당하는 숫자를 가능한 한 빠르고 정확하게 매치하도록 지시받는다. 첫 10개 문항은 연습용으로 피검자가 검사 규칙을 정확히 이해했는지 확인하는 과정이다. 오답이 있을 경우 검사자가 피드백을 제공하고 재교육한 후 본 검사를 시작한다. 제한 시간 90초 동안 110개의 항목을 시행하여 정답 개수를 점수로 기록한다. 구두형과 서면형 모두 가능하며 임상 시험에서는 감각 운동 기능의 영향을 최소화하기 위해 주로 구두형이 사용된다. 정답표는 검사자용 기록지에 인쇄되어 있어 채점이 빠르고 오류 가능성이 낮다.
임상적으로 유의한 변화는 기저 점수 대비 4점 이상 감소 또는 10% 이상 저하로 정의한다. SDMT 수행 저하는 EDSS 악화, 환자의 고용 능력 저하, 질병 활성도 증가와 유의한 상관관계를 보인다.42 SDMT는 시행이 간편하고 검사 시간이 5분 이내로 짧아 임상 현장에서도 반복 평가가 용이하다. 또한 나이, 성별, 교육 수준의 영향을 거의 받지 않으며 학습효과도 적다.26 그러나 시력 및 안구 운동 기능의 영향을 받을 수 있고 운동 제한이나 구음 장애가 있는 환자에서는 편향이 발생할 수 있다.41,43 Western psychological services가 저작권을 보유하고 있어 접근성에 제한이 따른다.
LCLA
시각 경로 기능을 평가하는 검사로 통상적인 고대비 시력 검사(high-contrast visual acuity test)로는 평가하기 어려운 대비 감도 저하(contrast sensitivity loss) 및 시각 경로 손상을 민감하게 탐지할 수 있다. LCLA는 검사자 간 일치도가 높고 신뢰도 및 타당도가 다양한 연구에서 입증되었다.44,45 검사실의 조명을 끄고 균일한 밝기를 제공하는 후방 조명 박스 위에 Sloan 저대비 시력표(2.5% 및 1.25% 대비도)를 설치하여 시행한다. 시력표는 흰색 배경 위에 회색 글자가 배열된 형태로 아래로 갈수록 글자의 크기가 점차 작아진다. 피검자는 2 m 거리에서 왼쪽 상단부터 글자를 읽어 내려가며 정확히 읽은 글자마다 1점을 부여하여 총점(최대 70점)을 산출한다. 검사는 단안 또는 양안으로 시행할 수 있다.
일반적으로 기저 점수 대비 7자 이상 감소를 임상적으로 유의한 악화로 정의한다. 7자 이상 감소는 시각 관련 삶의 질 저하나 망막신경섬유층 두께 감소와 연관된다.44,46 약 5분 이내에 시행 가능하며 저대비 시력은 읽기, 얼굴 인식, 운전 등 실제 환경에서의 시각 기능을 잘 반영하여 환자 보고 시각 기능 저하(patient-reported visual function)와 높은 상관성을 보인다.32 또한 LCLA는 MRI에서 T2 병변 부하, 시각 경로 병변, 뇌 용적 등과 연관된다는 보고가 있으며,47,48 향후 신경학적 장애 변화를 예측하는 데에도 추가적인 정보를 제공할 수 있다.49 주의할 점은 조도 등 환경적 요인의 영향을 받기 때문에 후방 조명 박스를 사용하지 않는 경우 주변 조명을 통제하는 등 표준화된 환경을 유지해야 한다.
Composite CDP (cCDP)
유럽 의약품청은 MSOAC의 분석 결과를 검토하여 네 가지 수행 검사의 타당성을 전반적으로 인정하였다. 다만 T25FW와 9HPT는 일상생활 수행 능력과의 연관 근거가 비교적 강한 반면 SDMT와 LCLA는 일상 기능이나 신체적 장애와의 직접적인 연관성을 보여주는 근거가 제한적이라고 판단하였다. 그리고 네 가지 수행 검사는 EDSS 없이 단독으로 1차 평가변수로 사용할 수는 없으며 복합 평가변수의 일부로 활용하는 것은 가능하다고 명시하였다.50 이러한 배경에서 EDSS와 수행 검사를 결합한 cCDP 개념이 제안되어 최근 임상 시험에서 1차 평가변수로 적용되고 있다.8
Kappos et al.8은 6개의 무작위 대조시험 자료(총 4,979명)를 통합 분석하여 cCDP의 임상적 유의성과 예측 타당도를 평가하였다. 이 연구에서 cCDP는 EDSS, T25FW, 9HPT 중 하나 이상에서 임상적으로 유의한 악화가 3개월 이상 지속되는 경우로 정의하였다(이하에서 각 검사의 ‘악화’는 임상적으로 유의한 악화를 의미한다). 분석 결과 cCDP 사건 발생률은 EDSS 단독으로 평가한 경우보다 약 두 배 높게 나타나 장애 진행을 더 민감하게 탐지함을 확인하였다.
T25FW 악화는 EDSS나 9HPT 악화보다 선행하는 경우가 많았다. EDSS 4.0 이상인 환자군에서는 EDSS 악화보다 9HPT 악화가 더 먼저 발생하는 경우가 많았는데 이는 보행 장애가 어느 정도 진행한 환자에서 9HPT를 통해 상지기능 악화가 민감하게 포착됨을 시사한다. 또한 조기에 T25FW 또는 9HPT 악화를 보인 환자는 향후 EDSS 악화를 보일 위험이 유의하게 높았으며 치료에 의한 T25FW 개선 효과는 EDSS의 개선과도 연동되었다.
이러한 결과는 cCDP가 EDSS 단독에 비해 장애 진행을 조기에 탐지하고 치료 반응을 평가하는데 유용한 임상적 의미를 지닌 1차 평가변수임을 시사한다.8 다만 향후 인지(SDMT) 및 시각(LCLA) 항목의 통합 여부, 유의한 장애 호전을 평가하는 기준의 설정, 수행 검사 간 상반된 변화(예: 어떤 기능은 호전되고 다른 기능은 악화)가 발생했을 때의 해석 기준 등 남은 쟁점들에 대한 논의가 필요하다.51
결론
최근 다발성경화증 환자 관리에서는 단순히 재발 빈도나 보행 기능의 악화만을 평가하는 접근에서 벗어나 인지·시각·상지 기능 등 다양한 신경학적 영역의 변화를 통합적으로 고려하여 관리하는 것이 환자의 삶의 질을 유지하는 데 중요하다는 인식이 확산되고 있다. EDSS는 여전히 다발성경화증의 핵심적인 장애 평가 지표이지만 T25FW, 9HPT, SDMT, LCLA와 같은 수행 검사를 병행함으로써 미세한 악화를 민감하게 탐지할 수 있다.
이러한 수행 검사들이 실제 진료 현장에 성공적으로 도입되기 위해서는 임상적 유용성뿐만 아니라 현실적인 적용 가능성에 대한 고려가 필요하다. 이들 검사의 가장 큰 장점은 반드시 의사에 의해서만 수행되어야 하는 것은 아니며 훈련된 검사자(간호사, 임상병리사 등)도 표준화된 절차에 따라 시행할 수 있다는 점이다. 이는 짧은 진료 시간 내에 많은 환자를 보아야 하는 국내 의료 환경에서 진료의 효율성을 높일 수 있음을 의미한다. 또한 대부분의 검사가 5분 이내에 완료될 수 있고 환자의 순응도가 높아 반복적인 추적 관찰에도 용이하다.
다만 국내 임상 현장에서의 광범위한 적용을 위해서 해결해야 할 과제들이 남아 있다. 첫째, 표준화된 검사 환경의 구축이다. 환경이 통제된 임상 시험과 달리 실제 진료실은 시간대, 조명, 소음 등 환경 변수가 다양하다. 예를 들어 공간이 협소한 외래 진료실에서는 T25FW를 시행하기 위한 25피트의 직선 보행로를 확보하는 것이 어려울 수 있다. 또한 LCLA는 표준화된 조도를 제공하는 후방 조명 박스가 필수적이나 이를 구비하고 관리하는 데 비용과 공간이 소요된다. 따라서 검사의 신뢰도를 담보할 수 있는 물리적 환경과 표준 운영 절차가 각 병원 사정에 맞춰 마련되어야 한다. 아울러 검사자가 변경되더라도 결과의 일관성이 유지될 수 있게 보조인력에 대한 정기적인 교육과 검증이 필요할 것이다. 둘째, 건강보험 수가 체계의 개선이다. 현재 EDSS를 포함해 다발성경화증 환자의 세밀한 기능 변화를 모니터링하기 위한 검사들이 별도로 산정 가능한 수가 코드가 부재한 실정이다. 장기적인 장애 누적을 억제하는 것이 결과적으로 환자의 삶의 질 유지와 사회적 비용 절감으로 이어진다는 점을 고려할 때 이러한 질환 특이적 기능 평가에 대한 급여 적용이나 수가 신설과 같은 제도적 뒷받침이 필요하다.
향후 임상 현장에서 수행 검사 시행을 위한 환경적, 제도적 장벽이 해소되고 적용이 확대된다면 의료진은 질환의 진행을 선제적으로 파악하여 치료 전략을 최적화할 수 있을 것이며 이는 궁극적으로 환자들의 장기적인 예후 향상에 기여할 것이다.
Notes
Acknowledgements
None.
Author Contributions
Writing, reviewing-editing: all authors.
Conflicts of Interest
There is no conflicts of interest.
Funding Statement
This study was supported by a grant from the Chonnam National University Hospital Biomedical Research Institute (BCRI 123030).
Data Availability Statement
Not applicable.
Ethical Approval
Not applicable.
Patient Consent for Publication
Not applicable.