다발성경화증의 MRI 특징에 대한 이해: 2017 McDonald 진단 기준에 근거하여
Understanding MRI Features of Multiple Sclerosis: Based on the 2017 McDonald Criteria
Article information
Trans Abstract
Since the McDonald criteria were first established for the diagnosis of multiple sclerosis (MS) in 2010, the role of MRI has become increasingly important. In order to diagnose MS as accurately as possible, neurologists should understand the McDonald MRI criteria and apply it appropriately. In this article, we review the definition of MS lesions, the exact location stated as dissemination in space in the 2017 McDonald criteria, and the new MS-specific MRI features.
서론
다발성경화증(multiple sclerosis, MS) 진단은 오직 중추신경계 염증성 탈수초 현상에 부합하는 증상과 신경학적 징후만을 인정하는 진단 기준에서 시작하여1 1983년 Poser 등2에 의해 뇌척수액 표지자(올리고클론띠, immunoglobulin G 지수)와 전기생리검사(유발전위 등) 같은 임상증상부속근거(paraclinical evidence)가 진단 기준에 포함되었고 이후 McDonald 진단 기준(2001-2017년)부터는 자기공명영상(MRI)이 MS 진단에 있어 매우 핵심적인 역할을 하기 시작하였다.3-5 MS 특이적인 중추신경계 내 시간적 파종(dissemination in time, DIT), 공간적 파종(dissemination in space, DIS) 입증에 있어서 객관적인 임상근거 외에 MRI 근거도 인정하게 된 것이다. 이러한 진단 기준의 변화는 MS 진단의 특이도를 훼손하지 않으면서도 민감도를 향상시키는 방향으로 이루어졌고, 특히 McDonald 진단 기준이 개정을 거듭함에 따라 첫 증상 발생 이후 MS 진단까지 소요되는 시간이 2년(Poser 기준)에서 6개월(2010 McDonald 기준)로 단축될 수 있었다.6 그러나 민감도가 높아지는 진단 기준 개정의 이면에는 MS 오진 위험성이 있음을 항상 염두에 두어야 하며7,8 McDonald 진단 기준 적용 시 전제 조건과 주의점에 대해서 숙지하고 있어야 한다. 즉 전형적인 임상적 단독증후군(clinically isolated syndrome)으로 발현한 경우에 한하여 적용하며, 유사질환을 배제하기 위한 진단적 절차가 반드시 필요하고, 과거 병력은 객관적인 증거가 있을 때에만 진단 기준에 포함한다.5,9
본 종설에서는 2017 McDonald 진단 기준에서 제시하고 있는 MRI 기준에 대해 알아보고, 최근 연구가 거듭되고 있는 T2* 강조영상 및 자화율강조영상(susceptibility weighted imaging)에서의 MS 특이적 소견에 대해서 간략히 알아보고자 한다.
본론
MS 병변의 정의(definition of MS lesion)
MRI에서의 MS 병변은 T2, T2-fluid-attenuated inversion recovery (T2-FLAIR), proton density (PD)와 같은 T2강조영상에서 원형(round) 또는 타원형(ovoid)의 고신호강도를 가리킨다. 비특이적인 T2 고신호강도와 구별하기 위해 MS 병변은 장축(long axis) 지름이 최소 3 mm 이상이어야 한다. 경우에 따라서 1-2 cm 이상 클 수도 있다. MRI 허상(artifact)에 의한 T2 고신호강도 가능성을 배제하기 위해 서로 다른 시퀀스, 예를 들어 T2와 T2-FLAIR 또는 T2와 PD 강조영상의 같은 위치에서 동시에 고신호강도가 보여야 한다. 또한 T2 고신호강도가 가급적 2개 이상 연속된 절편(slice)에서 보여야 MS 병변으로 간주하도록 권고하지만 MRI 영상을 3 mm 절편두께(slice thickness)보다 두껍게 획득하였을 경우에는 1개 절편에서만 보일 수도 있음을 감안해야 한다.
MS 병변은 중추신경계 내 어디든지 발생할 수 있다. 그러나 중추신경계를 침범하는 유사질환과 달리 특정 위치에 병변이 호발하는 독특한 특성이 있다. 예를 들어 뇌실주위백질(periventricular white matter, PVWM), 피질곁백질(juxtacortical white matter) 또는 피질(cortical), 뇌량(corpus callosum), 다리뇌와 소뇌 같은 천막하(infratentorial) 구조물, 경추부 척수(cervical spinal cord) 등이 호발 부위이며, 이러한 특정 위치가 McDonald 진단 기준의 MRI DIS에 반영되어 있다. McDonald 진단 기준의 MRI DIS 기준을 만족하려면 1) 뇌실주위백질, 2) 피질곁백질 또는 피질, 3) 천막하, 4) 척수 4개의 중추신경계 영역 중 최소 2개 이상의 영역에서 MS 전형적인 T2 고신호강도가 보여야 한다. 다음에서 DIS 기준에 대해 자세히 살펴보도록 하겠다.
공간적 파종(DIS) 기준
뇌실주위백질(PVWM)
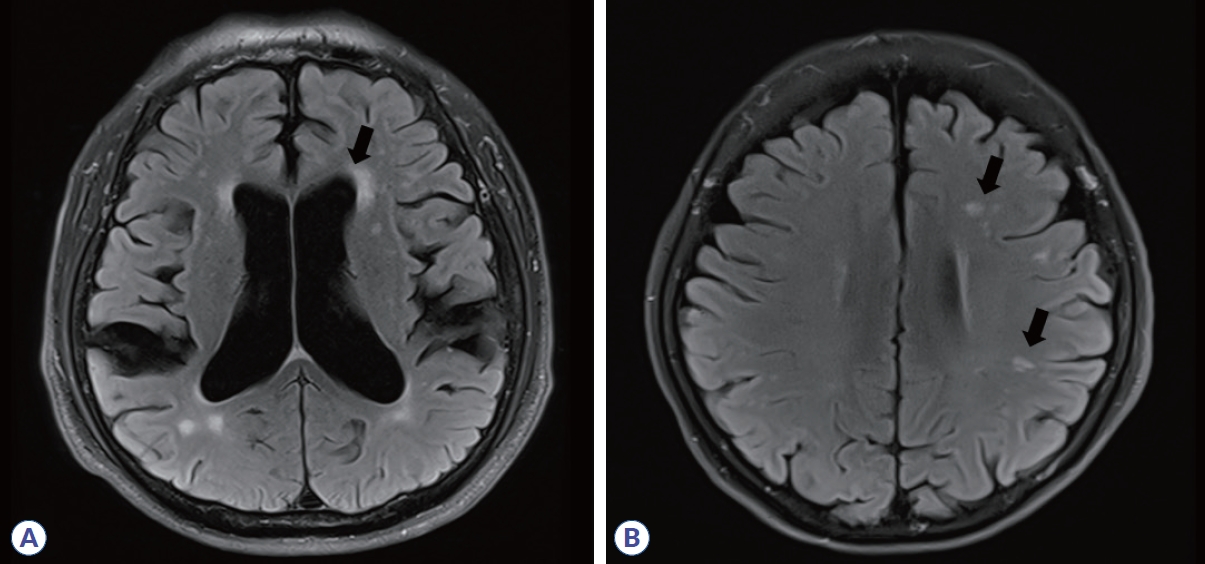
뇌실주위백질(PVWM) 병변은 가쪽뇌실(lateral ventricle)과 직접적으로 맞닿아 있는 T2 고신호강도로 정의한다. 병변과 가쪽뇌실 사이에 정상 백질이 끼어들어 있으면 안 된다(Fig. 1A). 가쪽뇌실과 직접 맞닿아 있는 뇌량의 T2 고신호강도도 뇌실주위백질 병변으로 포함될 수 있다. 하지만 T2 고신호강도가 가쪽뇌실과 직접 맞닿아 있더라도 꼬리핵(caudate nucleus)이나 시상(thalamus)과 같은 심부회색질에 위치한다면 뇌실주위백질 병변으로 포함시키지 않는다.10 또한 제3, 4뇌실에 직접 맞닿아 있는 T2 고신호강도도 뇌실주위백질 병변으로 포함시키지 않는다. McDonald 진단 기준의 ‘뇌실주위’는 가쪽뇌실을 지칭하며 제3, 4뇌실 및 수도관주위는 제외한다.

Examples of periventricular white matter lesions as referred to as dissemination in a space in the McDonald criteria. (A) White matter lesions in direct contact with the lateral ventricle without intervention in the normal white matter. (B) Characteristic periventricular white matter lesions which abut perpendicularly to the main axis of the lateral ventricles referred to as Dawson’s fingers.
특히 MS에서의 뇌실주위백질 병변은 타원형 T2 고신호강도의 장축이 가쪽뇌실에 대하여 수직 방향(perpendicular) 배열을 보이는 특징을 갖는데 이를 Dawson’s finger라고 지칭하며(Fig. 1B) 가쪽뇌실 근처에 백질 병변을 보일 수 있는 MS 유사질환과의 중요한 구별점이 된다. 병변의 이러한 공간적 배열(topographic)은 병리적으로 심부수질정맥(deep medullary vein) 주변부에 염증, 림프구 침윤과 활동성 MS판(active MS plaque)을 보이는 MS 특징과 일치한다11. 정상 노화에서 보일 수 있는 가쪽뇌실 뿔(horn of lateral ventricle)의 capping이나(Fig. 2A) 편두통, 허혈성 소혈관질환에서 보일 수 있는 T2 고신호강도(Fig. 2B)를 뇌실주위백질 병변으로 잘못 분류할 수 있어 주의가 필요하다.12,13 뇌량은 MS가 아닌 다른 중추신경계 염증성 탈수초질환에서도 병변이 쉽게 관찰되는 곳이다. Susac 증후군은 MS와 유사한 뇌량 병변이 보일 수 있는 드문 자가면역성 미세혈관병증으로 다음과 같은 형태의 뇌량 병변이 보일 수 있는데 원형의 T2 고신호강도가 뇌량 중심섬유(central fiber), 즉 가쪽뇌실과 뇌량 천장(roof, superior surface) 사이에 위치한 snowball 형태, 뇌량 천장으로부터 아래 방향으로 향하는 삼각형 고드름 모양의 icicle 형태, 뇌량 천장에 수직 방향으로 나타나는 부채살 모양의 spoke 형태 등은 Susac 증후군을 시사하는 특징적인 모양이다.14,15 시신경척수염범주질환(neuromyelitis optica spectrum disorder, NMOSD)은 라틴아메리카인, 흑인, 아시아인에서 MS보다 상대적으로 발생률이 높기 때문에 꼭 배제해야 하는 질환이며 NMOSD에서의 뇌량 병변은 불분명한 경계(blurred margin), 병변 주변부 T2 고신호강도와 중심부 T2 저신호강도를 이질적으로 보이는 marbled 형태, 뇌량 특히 팽대부위(splenium) 전체에 두꺼운 T2 고신호강도를 보이는 arch-bridge 형태, 병변 가장자리가 흐릿하면서 다발 반점형(multiple patchy) 조영증강을 보이는 cloud-like enhancement 형태가 특징적이다.16,17 앞서 언급한 뇌량 병변을 보일 경우 MS가 아닐 가능성이 높으며 뇌실주위백질 병변으로 분류해서도 안 된다.
피질곁백질 또는 피질 병변(juxtacortical JC or cortical lesion)
피질곁백질(JC) 병변은 정상 백질의 끼어듦 없이 피질에 직접적으로 맞닿아 있는 T2 고신호강도로 정의한다. T2-FLAIR 시퀀스에서 가장 발견하기 쉽다. MS의 피질곁백질 병변은 흔히 피질하 U섬유(subcortical U-fiber)를 침범하며(Fig. 3A), 반면 편두통이나 허혈성 소혈관질환은 피질 근처 백질에 병변이 있더라도 U섬유는 침범하지 않아 MS와 감별점이 된다.
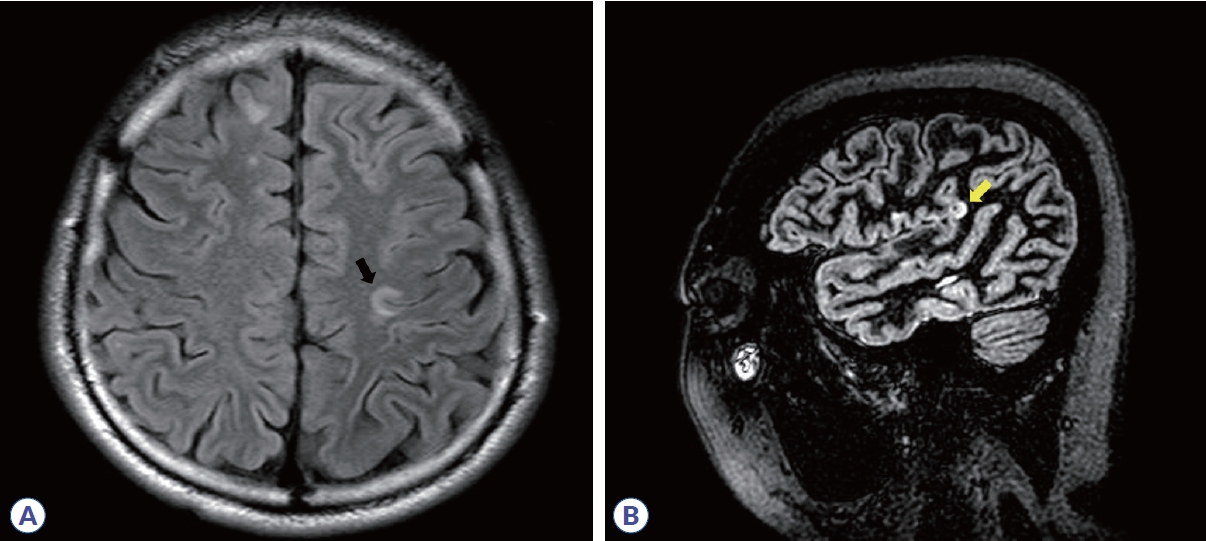
Juxtacortical/cortical lesions, which are referred to as dissemination in space in the McDonald criteria (images courtesy of Professor Su-Hyun Kim). (A) Multiple sclerosis lesion involving subcortical U-fibers (blak arrow). (B) Intracortical lesion of multiple sclerosis in a double inversion recovery sequence (yellow arrow).
피질 병변은 조직학적 소견에 따라 4가지 유형 즉, (1) type 1 leukocortical (MS판이 피질부터 U섬유를 포함한 피질곁백질까지 모두 침범한 경우), (2) type 2 intracortical (MS판이 연질막과 피질곁백질 모두 인접하지 않고 순수하게 피질 내에서만 있는 경우), (3) type 3 subpial demyelination (MS판이 연질막부터 시작하여 피질 내에 있는 경우), (4) type 4 (MS판이 피질 전체에 걸쳐 있지만 피질곁백질은 침범하지 않은 경우)로 분류한다18. T2-FLAIR 시퀀스에서 주로 관찰할 수 있지만 double inversion recovery, phase-sensitive inversion recovery 같은 특수 MRI를 이용할 경우 더 잘 볼 수 있으며 곡선 형태(curvilinear)의 피질 병변은 특히 MS 특이적이다(Fig. 3B).19 그러나 허상을 피질 병변으로 착오할 가능성이 높기 때문에 주의와 훈련이 필요하다. 실제 진료현장에서 주로 사용하는 1.5 또는 3.0 테슬라 MRI로는 피질 병변을 타입별로 명료하게 구분하기는 어렵기 때문에 leukocortical, intracortical, JC 모두 피질곁백질 병변으로 아울러 생각하기로 하였다.20
천막하 병변(infratentorial lesion)
천막하 병변은 뇌줄기, 소뇌다리(cerebellar peduncle), 소뇌에서 보이는 T2 고신호강도로 정의한다. 특히 다리뇌에서 가장 잘 관찰되며 주변부(periphery) 표면(surface)에 위치하는 경우가 많다. 소뇌다리뇌수조(cerebellopontine cistern)를 포함한 수조(cistern) 주위나 제4뇌실 근처, 삼차신경 진입부위(root entry zone of trigeminal nerve)처럼 수초가 풍부하면서 뇌척수액과 가까운 곳에서 볼 수 있다(Fig. 4A). 천막하 부위는 MS가 아닌 여러 중추신경계 질환에서도 병변이 발생하는 위치이기 때문에 배제 진단이 중요하다. 허혈성 소혈관질환은 각각의 관통동맥들이 혈류를 공급받기 때문에 경계구역(border zone)이 되기 쉬운 다리뇌 중심부에서 주로 T2 신호 변화가 보이며(Fig. 4B)13 NMOSD는 매우 특징적으로 맨아래구역(area postrema)이나 수도관주위(periaqueductal)에서 T2 고신호강도를 보인다(Fig. 4C).16 뇌줄기나 소뇌다리에 병변이 있되 형태가 솜털(fluffy)이나 구름처럼 퍼진(fuzzy) 경계이거나 양측성이거나 병변 크기가 수 cm 이상으로 클 경우 항말이집희소돌기아교세포당단백질항체관련질환(myelin oligodendrocyte glycoprotein antibody-associated disease, MOGAD)21 (Fig. 4D)이나 신경베체트병(neuro-behcet disease) 가능성이 있다.22
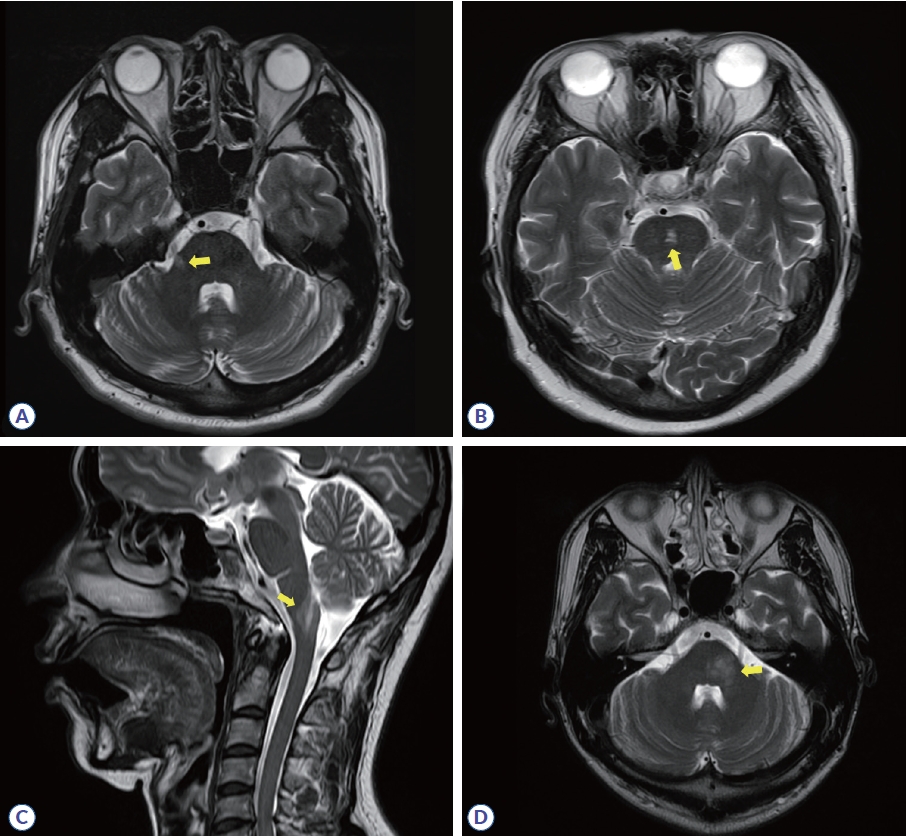
Infratentorial lesions in multiple sclerosis and its mimics. (A) Lesion involving the pontine trigeminal root entry zone in multiple sclerosis (yellow arrow). (B) Central pontine lesion in cerebral ischemic small-vessel disease (yellow arrow). (C) Lesion involving the postrema of the medulla oblongata in neuromyelitis optica spectrum disorder (yellow arrow). (D) Middle cerebellar peduncle lesion in anti-myelin oligodendrocyte glycoprotein-antibody disease (yellow arrow).
척수 병변(spinal cord lesion)
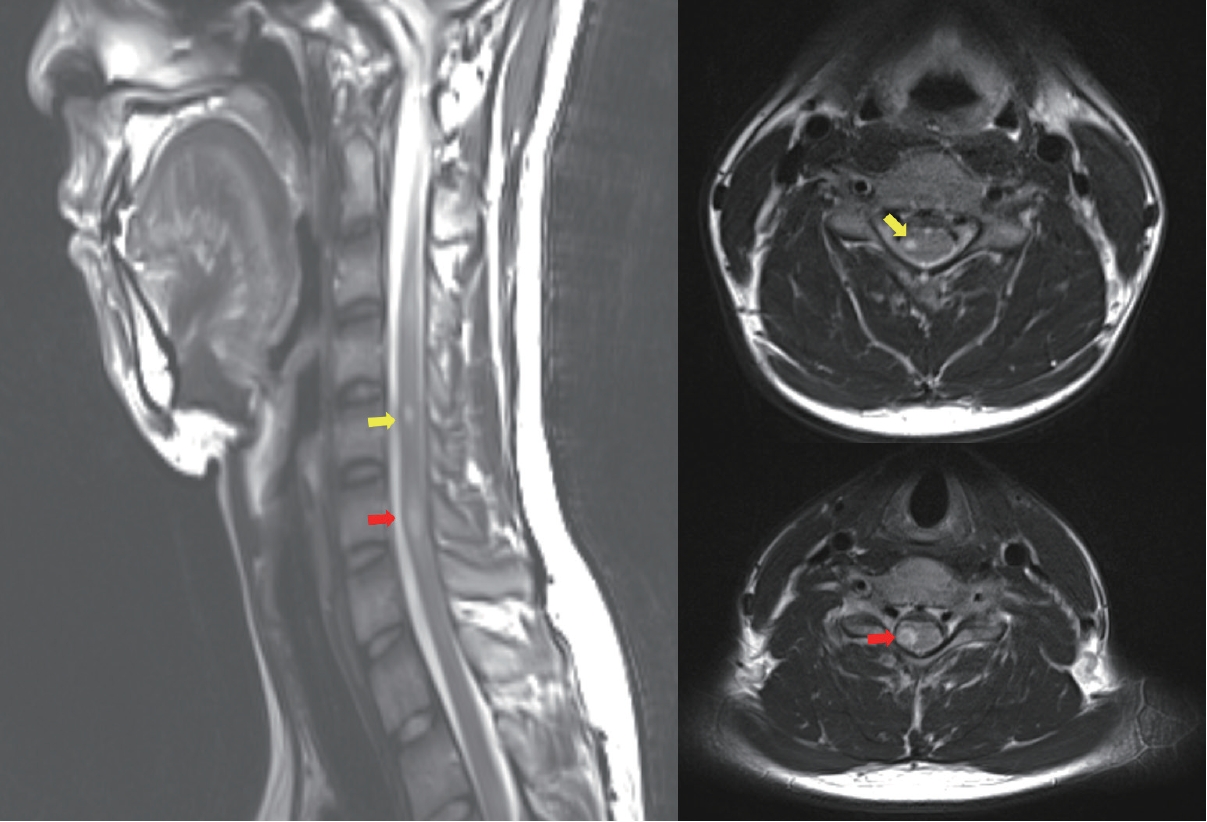
MS에서의 척수 병변은 뇌내 병변과 마찬가지로 원형 또는 타원형의 경계가 비교적 분명한 T2 고신호강도로 정의하며 경수 또는 경흉수 경계부위에서 자주 보인다. MS판일 가능성을 좀 더 시사하는 보조적 특징으로는 (1) 상하좌우 지름이 작아서 척수 단면적의 1/2 이하, 척추분절 2개 이하; (2) 시상면에서 담배 모양(cigar-shaped)이면서 축면(axial)에서 원형, 타원형, 또는 쐐기모양(wedge-shaped); (3) 척수 주변부(periphery), 그중에서도 가쪽기둥(lateral column)과 등쪽기둥(dorsal column)에 위치하는 공간적 배열 특성이 있다(Fig. 5).23,24 척추분절 3개 이상 길이이거나 척수 단면적 1/2 이상 지름의 광범위한 병변이거나 척수 중심부 회색질을 주로 침범하는 병변, 연수막(leptomeningeal) 조영증강이 두드러진 병변, 척수 부기(swelling)가 심한 병변, 등쪽기둥 선택적인 매우 긴 병변, 척수 원뿔(conus medullaris)에 주로 국한한 병변은 NMOSD, 신경사르코이드증(neurosarcoidosis), 감염, 척수종양, 영양결핍, MOGAD 가능성을 더 시사한다.24-26
시간적 파종(DIT) 기준
가돌리늄(gadolinium) 조영증강은 주로 새로 생긴 염증성 탈수초 병변에서 관찰되며 대개 2-8주 이내로 지속 기간이 짧기 때문에 오래된 병변과의 구분에 용이하고 시간적 파종을 입증하는 근거로 활용될 수 있다.27 조영증강 형태는 결절(nodular)이나 고리(ring) 조영증강 모두 보일 수 있다. 그러나 조영증강 형태가 매우 미만성(diffuse)이거나, 연수막 조영증강이 있거나, 국소 피질에만 조영증강이 보이거나, 동일한 병변이 3개월 이상 지속적으로 조영증강을 보이거나 모든 병변이 동시에 조영증강을 보인다면 MS가 아닐 가능성을 고려해야 한다.28,29 2010 McDonald 진단 기준은 서로 다른 무증상 MRI 병변이 조영증강되는 것과 조영증강되지 않는 것이 동시에 있을 때 DIT를 만족하는 것으로 보고 증상 유발 병변은 DIT 판단 시 제외하도록 하였으나 2017 진단 기준부터는 증상 유발 병변의 조영증강도 무증상 병변과 동일하게 DIT 기준에 포함되도록 개정되었다.
새롭게 부각되는 MS 특이적 소견(emerging MS-specific MRI features)
중심정맥신호(central vein sign, CVS)
앞서 언급한 것처럼 MS판은 조직학적으로 심부수질정맥 주변부에 잘 발생하는 특징을 가지고 있는데 MR 촬영기술이 발전함에 따라 영상으로 MS판과 판을 관통하는 심부중심정맥(central vein and venule)을 시각화할 수 있게 되었고 이를 중심정맥신호(CVS)라고 명명하였다. T2*강조영상(특히 T2* weighted segmented echo-planar imaging)과 FLAIR*영상에서 잘 관찰되며 자화율강조영상에서도 관찰할 수 있으나 전술한 영상보다는 CVS 검출에 있어 약간 열등하다. 이러한 촬영기술들은 백질 병변 내의 CVS 검출에 예민하기 때문에 MS와 비MS 병변 감별을 위한 연구에 많이 활용되었고 CVS 유무가 MS에 매우 특이적이라는 보고들이 누적되고 있다.30-32 CVS는 2 mm 미만 직경의 가는 선(line) 또는 점(dot) 모양 저신호강도로, 전형적인 MS판(장축 3 mm 이상의 원형 또는 타원형의 T2 고신호강도 병변) 한 가운데를 가로지르는 병변으로 정의한다(Fig. 6). MS 백질 병변에서는 1개의 CVS만 관찰되며 만약 여러 개의 정맥신호가 보이면 CVS로 간주하지 않는다. MS를 강하게 시사하는 CVS 관련 기준은 여러 가지가 제시되어 왔는데 (1) 전체 백질 병변의 40% 이상에서 CVS가 관찰되는 것, (2) 전형적인 CVS가 6개 이상 관찰되는 것, (3) 만약 백질 병변 총 개수가 6개 이하라면 모든 병변에서 CVS가 보여야 하는 것, (4) 전형적인 CVS가 3개 이상 관찰되는 것 등이 있었으며,30,33,34 총 병변 개수의 40% 이상 CVS 기준을 활용할 경우 비MS와의 감별진단 민감도는 61.3%, 특이도는 84.1%로 확인되었다.35
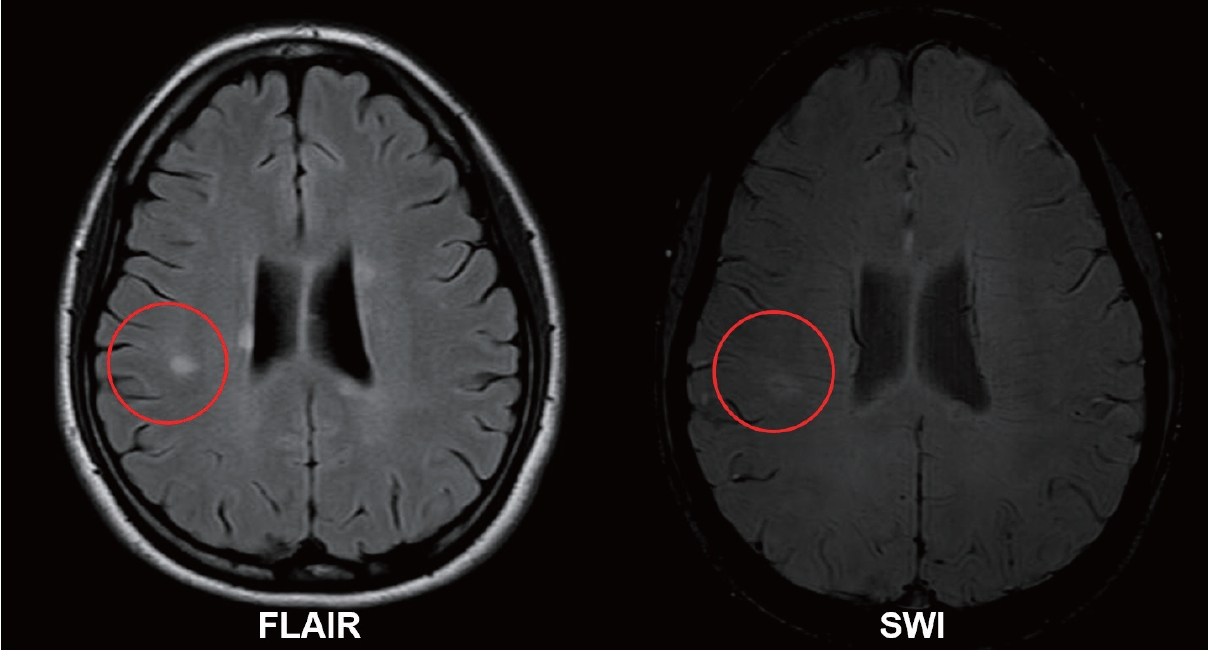
Examples of central vein sign. T2-hyperintense signal in the fluid-attenuated inversion recovery sequence (left image) and a thin, linear-shaped paramagnetic signal that runs centrally through the corresponding T2 lesion (right image) in conventional susceptibility-weighted imaging (courtesy of Professor Su-Hyun Kim). FLAIR, fluid-attenuated inversion recovery; SWI, susceptibility weighted imaging.
상자성 테두리 병변(paramagnetic rim lesion, PRL)
MS 이환 기간이 오래되거나 진행성 MS인 경우 병변 가장자리에서 만성 활동성 탈수초와 축삭소실이 지속되며 해당 부위에 높은 철을 함유하고 있는(iron-enriched) CD68+ 미세아교세포와 대식세포의 침윤이 발견되었는데 이러한 조직학적 특징이 자화율기반영상에서 MS판 주변부를 감싸고 있는 형태의 저신호강도 테두리로 보이게 되고 이를 iron-rim sign, PRL 또는 iron-rim lesion 등으로 부르고 있다.36-38 최근 연구에서는 39-66%의 MS 환자에서 최소 1개 이상의 PRL이 관찰된다고 하며, CVS와 마찬가지로 재발완화형, 진행형 MS 모두에서 관찰되고 비MS와 구분되는 중요한 영상학적 특징으로 제시되고 있다.39
결론
MS의 정확한 진단을 위해서는 McDonald 진단 기준 중 DIS, DIT 정의를 잘 이해하고 정확하게 적용해야 한다. 또한 MS 특징적인 MRI 병변 형태와 위치를 잘 알고 있어야 MS와 유사한 중추신경계 염증성 탈수초질환과 혼동을 막고 오진율을 낮출 수 있다. 병변 개수가 적을 경우에는 병변 크기(최소 3 mm 이상), 모양(타원형 또는 원형), 배열(가쪽 뇌실 기준 수직방향)이 MS에 부합하는지 살펴보고, 병변 개수가 많을 경우에는 병변 위치와 분포가 MS에 부합하는지 살펴보는 게 도움이 될 수 있다.10 마지막으로 CVS와 PRL은 새롭게 부상하고 있는 MS의 MRI 특징이므로 이에 대해 잘 이해해두고 향후 진단 기준에 포함되는지 지켜볼 필요가 있겠다.