| J Mult Scler Neuroimmunol > Volume 14(1); 2023 > Article |
|
ABSTRACT
Since the McDonald criteria were first established for the diagnosis of multiple sclerosis (MS) in 2010, the role of MRI has become increasingly important. In order to diagnose MS as accurately as possible, neurologists should understand the McDonald MRI criteria and apply it appropriately. In this article, we review the definition of MS lesions, the exact location stated as dissemination in space in the 2017 McDonald criteria, and the new MS-specific MRI features.
ļŗżļ░£ņä▒Ļ▓ĮĒÖöņ”Ø(multiple sclerosis, MS) ņ¦äļŗ©ņØĆ ņśżņ¦ü ņżæņČöņŗĀĻ▓ĮĻ│ä ņŚ╝ņ”Øņä▒ Ēāłņłśņ┤ł ĒśäņāüņŚÉ ļČĆĒĢ®ĒĢśļŖö ņ”ØņāüĻ│╝ ņŗĀĻ▓ĮĒĢÖņĀü ņ¦ĢĒøäļ¦īņØä ņØĖņĀĢĒĢśļŖö ņ¦äļŗ© ĻĖ░ņżĆņŚÉņä£ ņŗ£ņ×æĒĢśņŚ¼1 1983ļģä Poser ļō▒2ņŚÉ ņØśĒĢ┤ ļćīņ▓ÖņłśņĢĪ Ēæ£ņ¦Ćņ×É(ņś¼ļ”¼Ļ│ĀĒü┤ļĪĀļØĀ, immunoglobulin G ņ¦Ćņłś)ņÖĆ ņĀäĻĖ░ņāØļ”¼Ļ▓Ćņé¼(ņ£Āļ░£ņĀäņ£ä ļō▒) Ļ░ÖņØĆ ņ×äņāüņ”ØņāüļČĆņåŹĻĘ╝Ļ▒░(paraclinical evidence)Ļ░Ć ņ¦äļŗ© ĻĖ░ņżĆņŚÉ ĒżĒĢ©ļÉśņŚłĻ│Ā ņØ┤Ēøä McDonald ņ¦äļŗ© ĻĖ░ņżĆ(2001-2017ļģä)ļČĆĒä░ļŖö ņ×ÉĻĖ░Ļ│Ąļ¬ģņśüņāü(MRI)ņØ┤ MS ņ¦äļŗ©ņŚÉ ņ׳ņ¢┤ ļ¦żņÜ░ ĒĢĄņŗ¼ņĀüņØĖ ņŚŁĒĢĀņØä ĒĢśĻĖ░ ņŗ£ņ×æĒĢśņśĆļŗż.3-5 MS ĒŖ╣ņØ┤ņĀüņØĖ ņżæņČöņŗĀĻ▓ĮĻ│ä ļé┤ ņŗ£Ļ░äņĀü Ēīīņóģ(dissemination in time, DIT), Ļ│ĄĻ░äņĀü Ēīīņóģ(dissemination in space, DIS) ņ×ģņ”ØņŚÉ ņ׳ņ¢┤ņä£ Ļ░ØĻ┤ĆņĀüņØĖ ņ×äņāüĻĘ╝Ļ▒░ ņÖĖņŚÉ MRI ĻĘ╝Ļ▒░ļÅä ņØĖņĀĢĒĢśĻ▓ī ļÉ£ Ļ▓āņØ┤ļŗż. ņØ┤ļ¤¼ĒĢ£ ņ¦äļŗ© ĻĖ░ņżĆņØś ļ│ĆĒÖöļŖö MS ņ¦äļŗ©ņØś ĒŖ╣ņØ┤ļÅäļź╝ Ēø╝ņåÉĒĢśņ¦Ć ņĢŖņ£╝ļ®┤ņä£ļÅä ļ»╝Ļ░ÉļÅäļź╝ Ē¢źņāüņŗ£ĒéżļŖö ļ░®Ē¢źņ£╝ļĪ£ ņØ┤ļŻ©ņ¢┤ņĪīĻ│Ā, ĒŖ╣Ē׳ McDonald ņ¦äļŗ© ĻĖ░ņżĆņØ┤ Ļ░£ņĀĢņØä Ļ▒░ļōŁĒĢ©ņŚÉ ļö░ļØ╝ ņ▓½ ņ”Øņāü ļ░£ņāØ ņØ┤Ēøä MS ņ¦äļŗ©Ļ╣īņ¦Ć ņåīņÜöļÉśļŖö ņŗ£Ļ░äņØ┤ 2ļģä(Poser ĻĖ░ņżĆ)ņŚÉņä£ 6Ļ░£ņøö(2010 McDonald ĻĖ░ņżĆ)ļĪ£ ļŗ©ņČĢļÉĀ ņłś ņ׳ņŚłļŗż.6 ĻĘĖļ¤¼ļéś ļ»╝Ļ░ÉļÅäĻ░Ć ļåÆņĢäņ¦ĆļŖö ņ¦äļŗ© ĻĖ░ņżĆ Ļ░£ņĀĢņØś ņØ┤ļ®┤ņŚÉļŖö MS ņśżņ¦ä ņ£äĒŚśņä▒ņØ┤ ņ׳ņØīņØä ĒĢŁņāü ņŚ╝ļæÉņŚÉ ļæÉņ¢┤ņĢ╝ ĒĢśļ®░7,8 McDonald ņ¦äļŗ© ĻĖ░ņżĆ ņĀüņÜ® ņŗ£ ņĀäņĀ£ ņĪ░Ļ▒┤Ļ│╝ ņŻ╝ņØśņĀÉņŚÉ ļīĆĒĢ┤ņä£ ņłÖņ¦ĆĒĢśĻ│Ā ņ׳ņ¢┤ņĢ╝ ĒĢ£ļŗż. ņ”ē ņĀäĒśĢņĀüņØĖ ņ×äņāüņĀü ļŗ©ļÅģņ”ØĒøäĻĄ░(clinically isolated syndrome)ņ£╝ļĪ£ ļ░£ĒśäĒĢ£ Ļ▓ĮņÜ░ņŚÉ ĒĢ£ĒĢśņŚ¼ ņĀüņÜ®ĒĢśļ®░, ņ£Āņé¼ņ¦łĒÖśņØä ļ░░ņĀ£ĒĢśĻĖ░ ņ£äĒĢ£ ņ¦äļŗ©ņĀü ņĀłņ░©Ļ░Ć ļ░śļō£ņŗ£ ĒĢäņÜöĒĢśĻ│Ā, Ļ│╝Ļ▒░ ļ│æļĀźņØĆ Ļ░ØĻ┤ĆņĀüņØĖ ņ”ØĻ▒░Ļ░Ć ņ׳ņØä ļĢīņŚÉļ¦ī ņ¦äļŗ© ĻĖ░ņżĆņŚÉ ĒżĒĢ©ĒĢ£ļŗż.5,9
ļ│Ė ņóģņäżņŚÉņä£ļŖö 2017 McDonald ņ¦äļŗ© ĻĖ░ņżĆņŚÉņä£ ņĀ£ņŗ£ĒĢśĻ│Ā ņ׳ļŖö MRI ĻĖ░ņżĆņŚÉ ļīĆĒĢ┤ ņĢīņĢäļ│┤Ļ│Ā, ņĄ£ĻĘ╝ ņŚ░ĻĄ¼Ļ░Ć Ļ▒░ļōŁļÉśĻ│Ā ņ׳ļŖö T2* Ļ░ĢņĪ░ņśüņāü ļ░Å ņ×ÉĒÖöņ£©Ļ░ĢņĪ░ņśüņāü(susceptibility weighted imaging)ņŚÉņä£ņØś MS ĒŖ╣ņØ┤ņĀü ņåīĻ▓¼ņŚÉ ļīĆĒĢ┤ņä£ Ļ░äļץĒ׳ ņĢīņĢäļ│┤Ļ│Āņ×É ĒĢ£ļŗż.
MRIņŚÉņä£ņØś MS ļ│æļ│ĆņØĆ T2, T2-fluid-attenuated inversion recovery (T2-FLAIR), proton density (PD)ņÖĆ Ļ░ÖņØĆ T2Ļ░ĢņĪ░ņśüņāüņŚÉņä£ ņøÉĒśĢ(round) ļśÉļŖö ĒāĆņøÉĒśĢ(ovoid)ņØś Ļ│ĀņŗĀĒśĖĻ░ĢļÅäļź╝ Ļ░Ćļ”¼Ēé©ļŗż. ļ╣äĒŖ╣ņØ┤ņĀüņØĖ T2 Ļ│ĀņŗĀĒśĖĻ░ĢļÅäņÖĆ ĻĄ¼ļ│äĒĢśĻĖ░ ņ£äĒĢ┤ MS ļ│æļ│ĆņØĆ ņןņČĢ(long axis) ņ¦Ćļ”äņØ┤ ņĄ£ņåī 3 mm ņØ┤ņāüņØ┤ņ¢┤ņĢ╝ ĒĢ£ļŗż. Ļ▓ĮņÜ░ņŚÉ ļö░ļØ╝ņä£ 1-2 cm ņØ┤ņāü Ēü┤ ņłśļÅä ņ׳ļŗż. MRI ĒŚłņāü(artifact)ņŚÉ ņØśĒĢ£ T2 Ļ│ĀņŗĀĒśĖĻ░ĢļÅä Ļ░ĆļŖźņä▒ņØä ļ░░ņĀ£ĒĢśĻĖ░ ņ£äĒĢ┤ ņä£ļĪ£ ļŗżļźĖ ņŗ£ĒĆĆņŖż, ņśłļź╝ ļōżņ¢┤ T2ņÖĆ T2-FLAIR ļśÉļŖö T2ņÖĆ PD Ļ░ĢņĪ░ņśüņāüņØś Ļ░ÖņØĆ ņ£äņ╣śņŚÉņä£ ļÅÖņŗ£ņŚÉ Ļ│ĀņŗĀĒśĖĻ░ĢļÅäĻ░Ć ļ│┤ņŚ¼ņĢ╝ ĒĢ£ļŗż. ļśÉĒĢ£ T2 Ļ│ĀņŗĀĒśĖĻ░ĢļÅäĻ░Ć Ļ░ĆĻĖēņĀü 2Ļ░£ ņØ┤ņāü ņŚ░ņåŹļÉ£ ņĀłĒÄĖ(slice)ņŚÉņä£ ļ│┤ņŚ¼ņĢ╝ MS ļ│æļ│Ćņ£╝ļĪ£ Ļ░äņŻ╝ĒĢśļÅäļĪØ ĻČīĻ│ĀĒĢśņ¦Ćļ¦ī MRI ņśüņāüņØä 3 mm ņĀłĒÄĖļæÉĻ╗ś(slice thickness)ļ│┤ļŗż ļæÉĻ╗ŹĻ▓ī ĒÜŹļōØĒĢśņśĆņØä Ļ▓ĮņÜ░ņŚÉļŖö 1Ļ░£ ņĀłĒÄĖņŚÉņä£ļ¦ī ļ│┤ņØ╝ ņłśļÅä ņ׳ņØīņØä Ļ░ÉņĢłĒĢ┤ņĢ╝ ĒĢ£ļŗż.
MS ļ│æļ│ĆņØĆ ņżæņČöņŗĀĻ▓ĮĻ│ä ļé┤ ņ¢┤ļööļōĀņ¦Ć ļ░£ņāØĒĢĀ ņłś ņ׳ļŗż. ĻĘĖļ¤¼ļéś ņżæņČöņŗĀĻ▓ĮĻ│äļź╝ ņ╣©ļ▓öĒĢśļŖö ņ£Āņé¼ņ¦łĒÖśĻ│╝ ļŗ¼ļ”¼ ĒŖ╣ņĀĢ ņ£äņ╣śņŚÉ ļ│æļ│ĆņØ┤ ĒśĖļ░£ĒĢśļŖö ļÅģĒŖ╣ĒĢ£ ĒŖ╣ņä▒ņØ┤ ņ׳ļŗż. ņśłļź╝ ļōżņ¢┤ ļćīņŗżņŻ╝ņ£äļ░▒ņ¦ł(periventricular white matter, PVWM), Ēö╝ņ¦łĻ│üļ░▒ņ¦ł(juxtacortical white matter) ļśÉļŖö Ēö╝ņ¦ł(cortical), ļćīļ¤ē(corpus callosum), ļŗżļ”¼ļćīņÖĆ ņåīļćī Ļ░ÖņØĆ ņ▓£ļ¦ēĒĢś(infratentorial) ĻĄ¼ņĪ░ļ¼╝, Ļ▓ĮņČöļČĆ ņ▓Öņłś(cervical spinal cord) ļō▒ņØ┤ ĒśĖļ░£ ļČĆņ£äņØ┤ļ®░, ņØ┤ļ¤¼ĒĢ£ ĒŖ╣ņĀĢ ņ£äņ╣śĻ░Ć McDonald ņ¦äļŗ© ĻĖ░ņżĆņØś MRI DISņŚÉ ļ░śņśüļÉśņ¢┤ ņ׳ļŗż. McDonald ņ¦äļŗ© ĻĖ░ņżĆņØś MRI DIS ĻĖ░ņżĆņØä ļ¦īņĪ▒ĒĢśļĀżļ®┤ 1) ļćīņŗżņŻ╝ņ£äļ░▒ņ¦ł, 2) Ēö╝ņ¦łĻ│üļ░▒ņ¦ł ļśÉļŖö Ēö╝ņ¦ł, 3) ņ▓£ļ¦ēĒĢś, 4) ņ▓Öņłś 4Ļ░£ņØś ņżæņČöņŗĀĻ▓ĮĻ│ä ņśüņŚŁ ņżæ ņĄ£ņåī 2Ļ░£ ņØ┤ņāüņØś ņśüņŚŁņŚÉņä£ MS ņĀäĒśĢņĀüņØĖ T2 Ļ│ĀņŗĀĒśĖĻ░ĢļÅäĻ░Ć ļ│┤ņŚ¼ņĢ╝ ĒĢ£ļŗż. ļŗżņØīņŚÉņä£ DIS ĻĖ░ņżĆņŚÉ ļīĆĒĢ┤ ņ×ÉņäĖĒ׳ ņé┤ĒÄ┤ļ│┤ļÅäļĪØ ĒĢśĻ▓Āļŗż.
ļćīņŗżņŻ╝ņ£äļ░▒ņ¦ł(PVWM) ļ│æļ│ĆņØĆ Ļ░Ćņ¬Įļćīņŗż(lateral ventricle)Ļ│╝ ņ¦üņĀæņĀüņ£╝ļĪ£ ļ¦×ļŗ┐ņĢä ņ׳ļŖö T2 Ļ│ĀņŗĀĒśĖĻ░ĢļÅäļĪ£ ņĀĢņØśĒĢ£ļŗż. ļ│æļ│ĆĻ│╝ Ļ░Ćņ¬Įļćīņŗż ņé¼ņØ┤ņŚÉ ņĀĢņāü ļ░▒ņ¦łņØ┤ ļü╝ņ¢┤ļōżņ¢┤ ņ׳ņ£╝ļ®┤ ņĢł ļÉ£ļŗż(Fig. 1A). Ļ░Ćņ¬ĮļćīņŗżĻ│╝ ņ¦üņĀæ ļ¦×ļŗ┐ņĢä ņ׳ļŖö ļćīļ¤ēņØś T2 Ļ│ĀņŗĀĒśĖĻ░ĢļÅäļÅä ļćīņŗżņŻ╝ņ£äļ░▒ņ¦ł ļ│æļ│Ćņ£╝ļĪ£ ĒżĒĢ©ļÉĀ ņłś ņ׳ļŗż. ĒĢśņ¦Ćļ¦ī T2 Ļ│ĀņŗĀĒśĖĻ░ĢļÅäĻ░Ć Ļ░Ćņ¬ĮļćīņŗżĻ│╝ ņ¦üņĀæ ļ¦×ļŗ┐ņĢä ņ׳ļŹöļØ╝ļÅä Ļ╝¼ļ”¼ĒĢĄ(caudate nucleus)ņØ┤ļéś ņŗ£ņāü(thalamus)Ļ│╝ Ļ░ÖņØĆ ņŗ¼ļČĆĒÜīņāēņ¦łņŚÉ ņ£äņ╣śĒĢ£ļŗżļ®┤ ļćīņŗżņŻ╝ņ£äļ░▒ņ¦ł ļ│æļ│Ćņ£╝ļĪ£ ĒżĒĢ©ņŗ£Ēéżņ¦Ć ņĢŖļŖöļŗż.10 ļśÉĒĢ£ ņĀ£3, 4ļćīņŗżņŚÉ ņ¦üņĀæ ļ¦×ļŗ┐ņĢä ņ׳ļŖö T2 Ļ│ĀņŗĀĒśĖĻ░ĢļÅäļÅä ļćīņŗżņŻ╝ņ£äļ░▒ņ¦ł ļ│æļ│Ćņ£╝ļĪ£ ĒżĒĢ©ņŗ£Ēéżņ¦Ć ņĢŖļŖöļŗż. McDonald ņ¦äļŗ© ĻĖ░ņżĆņØś ŌĆśļćīņŗżņŻ╝ņ£äŌĆÖļŖö Ļ░Ćņ¬ĮļćīņŗżņØä ņ¦Ćņ╣ŁĒĢśļ®░ ņĀ£3, 4ļćīņŗż ļ░Å ņłśļÅäĻ┤ĆņŻ╝ņ£äļŖö ņĀ£ņÖĖĒĢ£ļŗż.
ĒŖ╣Ē׳ MSņŚÉņä£ņØś ļćīņŗżņŻ╝ņ£äļ░▒ņ¦ł ļ│æļ│ĆņØĆ ĒāĆņøÉĒśĢ T2 Ļ│ĀņŗĀĒśĖĻ░ĢļÅäņØś ņןņČĢņØ┤ Ļ░Ćņ¬ĮļćīņŗżņŚÉ ļīĆĒĢśņŚ¼ ņłśņ¦ü ļ░®Ē¢ź(perpendicular) ļ░░ņŚ┤ņØä ļ│┤ņØ┤ļŖö ĒŖ╣ņ¦ĢņØä Ļ░¢ļŖöļŹ░ ņØ┤ļź╝ DawsonŌĆÖs fingerļØ╝Ļ│Ā ņ¦Ćņ╣ŁĒĢśļ®░(Fig. 1B) Ļ░Ćņ¬Įļćīņŗż ĻĘ╝ņ▓śņŚÉ ļ░▒ņ¦ł ļ│æļ│ĆņØä ļ│┤ņØ╝ ņłś ņ׳ļŖö MS ņ£Āņé¼ņ¦łĒÖśĻ│╝ņØś ņżæņÜöĒĢ£ ĻĄ¼ļ│äņĀÉņØ┤ ļÉ£ļŗż. ļ│æļ│ĆņØś ņØ┤ļ¤¼ĒĢ£ Ļ│ĄĻ░äņĀü ļ░░ņŚ┤(topographic)ņØĆ ļ│æļ”¼ņĀüņ£╝ļĪ£ ņŗ¼ļČĆņłśņ¦łņĀĢļ¦ź(deep medullary vein) ņŻ╝ļ│ĆļČĆņŚÉ ņŚ╝ņ”Ø, ļ”╝ĒöäĻĄ¼ ņ╣©ņ£żĻ│╝ ĒÖ£ļÅÖņä▒ MSĒīÉ(active MS plaque)ņØä ļ│┤ņØ┤ļŖö MS ĒŖ╣ņ¦ĢĻ│╝ ņØ╝ņ╣śĒĢ£ļŗż11. ņĀĢņāü ļģĖĒÖöņŚÉņä£ ļ│┤ņØ╝ ņłś ņ׳ļŖö Ļ░Ćņ¬Įļćīņŗż ļ┐ö(horn of lateral ventricle)ņØś cappingņØ┤ļéś(Fig. 2A) ĒÄĖļæÉĒåĄ, ĒŚłĒśłņä▒ ņåīĒśłĻ┤Ćņ¦łĒÖśņŚÉņä£ ļ│┤ņØ╝ ņłś ņ׳ļŖö T2 Ļ│ĀņŗĀĒśĖĻ░ĢļÅä(Fig. 2B)ļź╝ ļćīņŗżņŻ╝ņ£äļ░▒ņ¦ł ļ│æļ│Ćņ£╝ļĪ£ ņלļ¬╗ ļČäļźśĒĢĀ ņłś ņ׳ņ¢┤ ņŻ╝ņØśĻ░Ć ĒĢäņÜöĒĢśļŗż.12,13 ļćīļ¤ēņØĆ MSĻ░Ć ņĢäļŗī ļŗżļźĖ ņżæņČöņŗĀĻ▓ĮĻ│ä ņŚ╝ņ”Øņä▒ Ēāłņłśņ┤łņ¦łĒÖśņŚÉņä£ļÅä ļ│æļ│ĆņØ┤ ņēĮĻ▓ī Ļ┤Ćņ░░ļÉśļŖö Ļ││ņØ┤ļŗż. Susac ņ”ØĒøäĻĄ░ņØĆ MSņÖĆ ņ£Āņé¼ĒĢ£ ļćīļ¤ē ļ│æļ│ĆņØ┤ ļ│┤ņØ╝ ņłś ņ׳ļŖö ļō£ļ¼Ė ņ×ÉĻ░Ćļ®┤ņŚŁņä▒ ļ»ĖņäĖĒśłĻ┤Ćļ│æņ”Øņ£╝ļĪ£ ļŗżņØīĻ│╝ Ļ░ÖņØĆ ĒśĢĒā£ņØś ļćīļ¤ē ļ│æļ│ĆņØ┤ ļ│┤ņØ╝ ņłś ņ׳ļŖöļŹ░ ņøÉĒśĢņØś T2 Ļ│ĀņŗĀĒśĖĻ░ĢļÅäĻ░Ć ļćīļ¤ē ņżæņŗ¼ņä¼ņ£Ā(central fiber), ņ”ē Ļ░Ćņ¬ĮļćīņŗżĻ│╝ ļćīļ¤ē ņ▓£ņן(roof, superior surface) ņé¼ņØ┤ņŚÉ ņ£äņ╣śĒĢ£ snowball ĒśĢĒā£, ļćīļ¤ē ņ▓£ņןņ£╝ļĪ£ļČĆĒä░ ņĢäļל ļ░®Ē¢źņ£╝ļĪ£ Ē¢źĒĢśļŖö ņé╝Ļ░üĒśĢ Ļ│Āļō£ļ”ä ļ¬©ņ¢æņØś icicle ĒśĢĒā£, ļćīļ¤ē ņ▓£ņןņŚÉ ņłśņ¦ü ļ░®Ē¢źņ£╝ļĪ£ ļéśĒāĆļéśļŖö ļČĆņ▒äņé┤ ļ¬©ņ¢æņØś spoke ĒśĢĒā£ ļō▒ņØĆ Susac ņ”ØĒøäĻĄ░ņØä ņŗ£ņé¼ĒĢśļŖö ĒŖ╣ņ¦ĢņĀüņØĖ ļ¬©ņ¢æņØ┤ļŗż.14,15 ņŗ£ņŗĀĻ▓Įņ▓ÖņłśņŚ╝ļ▓öņŻ╝ņ¦łĒÖś(neuromyelitis optica spectrum disorder, NMOSD)ņØĆ ļØ╝Ēŗ┤ņĢäļ®öļ”¼ņ╣┤ņØĖ, ĒØæņØĖ, ņĢäņŗ£ņĢäņØĖņŚÉņä£ MSļ│┤ļŗż ņāüļīĆņĀüņ£╝ļĪ£ ļ░£ņāØļźĀņØ┤ ļåÆĻĖ░ ļĢīļ¼ĖņŚÉ Ļ╝Ł ļ░░ņĀ£ĒĢ┤ņĢ╝ ĒĢśļŖö ņ¦łĒÖśņØ┤ļ®░ NMOSDņŚÉņä£ņØś ļćīļ¤ē ļ│æļ│ĆņØĆ ļČłļČäļ¬ģĒĢ£ Ļ▓ĮĻ│ä(blurred margin), ļ│æļ│Ć ņŻ╝ļ│ĆļČĆ T2 Ļ│ĀņŗĀĒśĖĻ░ĢļÅäņÖĆ ņżæņŗ¼ļČĆ T2 ņĀĆņŗĀĒśĖĻ░ĢļÅäļź╝ ņØ┤ņ¦łņĀüņ£╝ļĪ£ ļ│┤ņØ┤ļŖö marbled ĒśĢĒā£, ļćīļ¤ē ĒŖ╣Ē׳ ĒīĮļīĆļČĆņ£ä(splenium) ņĀäņ▓┤ņŚÉ ļæÉĻ║╝ņÜ┤ T2 Ļ│ĀņŗĀĒśĖĻ░ĢļÅäļź╝ ļ│┤ņØ┤ļŖö arch-bridge ĒśĢĒā£, ļ│æļ│Ć Ļ░Ćņןņ×Éļ”¼Ļ░Ć ĒØÉļ”┐ĒĢśļ®┤ņä£ ļŗżļ░£ ļ░śņĀÉĒśĢ(multiple patchy) ņĪ░ņśüņ”ØĻ░ĢņØä ļ│┤ņØ┤ļŖö cloud-like enhancement ĒśĢĒā£Ļ░Ć ĒŖ╣ņ¦ĢņĀüņØ┤ļŗż.16,17 ņĢ×ņä£ ņ¢ĖĻĖēĒĢ£ ļćīļ¤ē ļ│æļ│ĆņØä ļ│┤ņØ╝ Ļ▓ĮņÜ░ MSĻ░Ć ņĢäļŗÉ Ļ░ĆļŖźņä▒ņØ┤ ļåÆņ£╝ļ®░ ļćīņŗżņŻ╝ņ£äļ░▒ņ¦ł ļ│æļ│Ćņ£╝ļĪ£ ļČäļźśĒĢ┤ņä£ļÅä ņĢł ļÉ£ļŗż.
Ēö╝ņ¦łĻ│üļ░▒ņ¦ł(JC) ļ│æļ│ĆņØĆ ņĀĢņāü ļ░▒ņ¦łņØś ļü╝ņ¢┤ļō” ņŚåņØ┤ Ēö╝ņ¦łņŚÉ ņ¦üņĀæņĀüņ£╝ļĪ£ ļ¦×ļŗ┐ņĢä ņ׳ļŖö T2 Ļ│ĀņŗĀĒśĖĻ░ĢļÅäļĪ£ ņĀĢņØśĒĢ£ļŗż. T2-FLAIR ņŗ£ĒĆĆņŖżņŚÉņä£ Ļ░Ćņן ļ░£Ļ▓¼ĒĢśĻĖ░ ņēĮļŗż. MSņØś Ēö╝ņ¦łĻ│üļ░▒ņ¦ł ļ│æļ│ĆņØĆ ĒØöĒ׳ Ēö╝ņ¦łĒĢś Uņä¼ņ£Ā(subcortical U-fiber)ļź╝ ņ╣©ļ▓öĒĢśļ®░(Fig. 3A), ļ░śļ®┤ ĒÄĖļæÉĒåĄņØ┤ļéś ĒŚłĒśłņä▒ ņåīĒśłĻ┤Ćņ¦łĒÖśņØĆ Ēö╝ņ¦ł ĻĘ╝ņ▓ś ļ░▒ņ¦łņŚÉ ļ│æļ│ĆņØ┤ ņ׳ļŹöļØ╝ļÅä Uņä¼ņ£ĀļŖö ņ╣©ļ▓öĒĢśņ¦Ć ņĢŖņĢä MSņÖĆ Ļ░Éļ│äņĀÉņØ┤ ļÉ£ļŗż.
Ēö╝ņ¦ł ļ│æļ│ĆņØĆ ņĪ░ņ¦üĒĢÖņĀü ņåīĻ▓¼ņŚÉ ļö░ļØ╝ 4Ļ░Ćņ¦Ć ņ£ĀĒśĢ ņ”ē, (1) type 1 leukocortical (MSĒīÉņØ┤ Ēö╝ņ¦łļČĆĒä░ Uņä¼ņ£Āļź╝ ĒżĒĢ©ĒĢ£ Ēö╝ņ¦łĻ│üļ░▒ņ¦łĻ╣īņ¦Ć ļ¬©ļæÉ ņ╣©ļ▓öĒĢ£ Ļ▓ĮņÜ░), (2) type 2 intracortical (MSĒīÉņØ┤ ņŚ░ņ¦łļ¦ēĻ│╝ Ēö╝ņ¦łĻ│üļ░▒ņ¦ł ļ¬©ļæÉ ņØĖņĀæĒĢśņ¦Ć ņĢŖĻ│Ā ņł£ņłśĒĢśĻ▓ī Ēö╝ņ¦ł ļé┤ņŚÉņä£ļ¦ī ņ׳ļŖö Ļ▓ĮņÜ░), (3) type 3 subpial demyelination (MSĒīÉņØ┤ ņŚ░ņ¦łļ¦ēļČĆĒä░ ņŗ£ņ×æĒĢśņŚ¼ Ēö╝ņ¦ł ļé┤ņŚÉ ņ׳ļŖö Ļ▓ĮņÜ░), (4) type 4 (MSĒīÉņØ┤ Ēö╝ņ¦ł ņĀäņ▓┤ņŚÉ Ļ▒Ėņ│É ņ׳ņ¦Ćļ¦ī Ēö╝ņ¦łĻ│üļ░▒ņ¦łņØĆ ņ╣©ļ▓öĒĢśņ¦Ć ņĢŖņØĆ Ļ▓ĮņÜ░)ļĪ£ ļČäļźśĒĢ£ļŗż18. T2-FLAIR ņŗ£ĒĆĆņŖżņŚÉņä£ ņŻ╝ļĪ£ Ļ┤Ćņ░░ĒĢĀ ņłś ņ׳ņ¦Ćļ¦ī double inversion recovery, phase-sensitive inversion recovery Ļ░ÖņØĆ ĒŖ╣ņłś MRIļź╝ ņØ┤ņÜ®ĒĢĀ Ļ▓ĮņÜ░ ļŹö ņל ļ│╝ ņłś ņ׳ņ£╝ļ®░ Ļ│ĪņäĀ ĒśĢĒā£(curvilinear)ņØś Ēö╝ņ¦ł ļ│æļ│ĆņØĆ ĒŖ╣Ē׳ MS ĒŖ╣ņØ┤ņĀüņØ┤ļŗż(Fig. 3B).19 ĻĘĖļ¤¼ļéś ĒŚłņāüņØä Ēö╝ņ¦ł ļ│æļ│Ćņ£╝ļĪ£ ņ░®ņśżĒĢĀ Ļ░ĆļŖźņä▒ņØ┤ ļåÆĻĖ░ ļĢīļ¼ĖņŚÉ ņŻ╝ņØśņÖĆ ĒøłļĀ©ņØ┤ ĒĢäņÜöĒĢśļŗż. ņŗżņĀ£ ņ¦äļŻīĒśäņןņŚÉņä£ ņŻ╝ļĪ£ ņé¼ņÜ®ĒĢśļŖö 1.5 ļśÉļŖö 3.0 ĒģīņŖ¼ļØ╝ MRIļĪ£ļŖö Ēö╝ņ¦ł ļ│æļ│ĆņØä ĒāĆņ×ģļ│äļĪ£ ļ¬ģļŻīĒĢśĻ▓ī ĻĄ¼ļČäĒĢśĻĖ░ļŖö ņ¢┤ļĀĄĻĖ░ ļĢīļ¼ĖņŚÉ leukocortical, intracortical, JC ļ¬©ļæÉ Ēö╝ņ¦łĻ│üļ░▒ņ¦ł ļ│æļ│Ćņ£╝ļĪ£ ņĢäņÜĖļ¤¼ ņāØĻ░üĒĢśĻĖ░ļĪ£ ĒĢśņśĆļŗż.20
ņ▓£ļ¦ēĒĢś ļ│æļ│ĆņØĆ ļćīņżäĻĖ░, ņåīļćīļŗżļ”¼(cerebellar peduncle), ņåīļćīņŚÉņä£ ļ│┤ņØ┤ļŖö T2 Ļ│ĀņŗĀĒśĖĻ░ĢļÅäļĪ£ ņĀĢņØśĒĢ£ļŗż. ĒŖ╣Ē׳ ļŗżļ”¼ļćīņŚÉņä£ Ļ░Ćņן ņל Ļ┤Ćņ░░ļÉśļ®░ ņŻ╝ļ│ĆļČĆ(periphery) Ēæ£ļ®┤(surface)ņŚÉ ņ£äņ╣śĒĢśļŖö Ļ▓ĮņÜ░Ļ░Ć ļ¦Äļŗż. ņåīļćīļŗżļ”¼ļćīņłśņĪ░(cerebellopontine cistern)ļź╝ ĒżĒĢ©ĒĢ£ ņłśņĪ░(cistern) ņŻ╝ņ£äļéś ņĀ£4ļćīņŗż ĻĘ╝ņ▓ś, ņé╝ņ░©ņŗĀĻ▓Į ņ¦äņ×ģļČĆņ£ä(root entry zone of trigeminal nerve)ņ▓śļ¤╝ ņłśņ┤łĻ░Ć ĒÆŹļČĆĒĢśļ®┤ņä£ ļćīņ▓ÖņłśņĢĪĻ│╝ Ļ░ĆĻ╣īņÜ┤ Ļ││ņŚÉņä£ ļ│╝ ņłś ņ׳ļŗż(Fig. 4A). ņ▓£ļ¦ēĒĢś ļČĆņ£äļŖö MSĻ░Ć ņĢäļŗī ņŚ¼ļ¤¼ ņżæņČöņŗĀĻ▓ĮĻ│ä ņ¦łĒÖśņŚÉņä£ļÅä ļ│æļ│ĆņØ┤ ļ░£ņāØĒĢśļŖö ņ£äņ╣śņØ┤ĻĖ░ ļĢīļ¼ĖņŚÉ ļ░░ņĀ£ ņ¦äļŗ©ņØ┤ ņżæņÜöĒĢśļŗż. ĒŚłĒśłņä▒ ņåīĒśłĻ┤Ćņ¦łĒÖśņØĆ Ļ░üĻ░üņØś Ļ┤ĆĒåĄļÅÖļ¦źļōżņØ┤ Ēśłļźśļź╝ Ļ│ĄĻĖēļ░øĻĖ░ ļĢīļ¼ĖņŚÉ Ļ▓ĮĻ│äĻĄ¼ņŚŁ(border zone)ņØ┤ ļÉśĻĖ░ ņē¼ņÜ┤ ļŗżļ”¼ļćī ņżæņŗ¼ļČĆņŚÉņä£ ņŻ╝ļĪ£ T2 ņŗĀĒśĖ ļ│ĆĒÖöĻ░Ć ļ│┤ņØ┤ļ®░(Fig. 4B)13 NMOSDļŖö ļ¦żņÜ░ ĒŖ╣ņ¦ĢņĀüņ£╝ļĪ£ ļ¦©ņĢäļלĻĄ¼ņŚŁ(area postrema)ņØ┤ļéś ņłśļÅäĻ┤ĆņŻ╝ņ£ä(periaqueductal)ņŚÉņä£ T2 Ļ│ĀņŗĀĒśĖĻ░ĢļÅäļź╝ ļ│┤ņØĖļŗż(Fig. 4C).16 ļćīņżäĻĖ░ļéś ņåīļćīļŗżļ”¼ņŚÉ ļ│æļ│ĆņØ┤ ņ׳ļÉś ĒśĢĒā£Ļ░Ć ņå£ĒäĖ(fluffy)ņØ┤ļéś ĻĄ¼ļ”äņ▓śļ¤╝ ĒŹ╝ņ¦ä(fuzzy) Ļ▓ĮĻ│äņØ┤Ļ▒░ļéś ņ¢æņĖĪņä▒ņØ┤Ļ▒░ļéś ļ│æļ│Ć Ēü¼ĻĖ░Ļ░Ć ņłś cm ņØ┤ņāüņ£╝ļĪ£ Ēü┤ Ļ▓ĮņÜ░ ĒĢŁļ¦ÉņØ┤ņ¦æĒؼņåīļÅīĻĖ░ņĢäĻĄÉņäĖĒżļŗ╣ļŗ©ļ░▒ņ¦łĒĢŁņ▓┤Ļ┤ĆļĀ©ņ¦łĒÖś(myelin oligodendrocyte glycoprotein antibody-associated disease, MOGAD)21 (Fig. 4D)ņØ┤ļéś ņŗĀĻ▓Įļ▓Āņ▓┤ĒŖĖļ│æ(neuro-behcet disease) Ļ░ĆļŖźņä▒ņØ┤ ņ׳ļŗż.22
MSņŚÉņä£ņØś ņ▓Öņłś ļ│æļ│ĆņØĆ ļćīļé┤ ļ│æļ│ĆĻ│╝ ļ¦łņ░¼Ļ░Ćņ¦ĆļĪ£ ņøÉĒśĢ ļśÉļŖö ĒāĆņøÉĒśĢņØś Ļ▓ĮĻ│äĻ░Ć ļ╣äĻĄÉņĀü ļČäļ¬ģĒĢ£ T2 Ļ│ĀņŗĀĒśĖĻ░ĢļÅäļĪ£ ņĀĢņØśĒĢśļ®░ Ļ▓Įņłś ļśÉļŖö Ļ▓ĮĒØēņłś Ļ▓ĮĻ│äļČĆņ£äņŚÉņä£ ņ×ÉņŻ╝ ļ│┤ņØĖļŗż. MSĒīÉņØ╝ Ļ░ĆļŖźņä▒ņØä ņóĆ ļŹö ņŗ£ņé¼ĒĢśļŖö ļ│┤ņĪ░ņĀü ĒŖ╣ņ¦Ģņ£╝ļĪ£ļŖö (1) ņāüĒĢśņóīņÜ░ ņ¦Ćļ”äņØ┤ ņ×æņĢäņä£ ņ▓Öņłś ļŗ©ļ®┤ņĀüņØś 1/2 ņØ┤ĒĢś, ņ▓ÖņČöļČäņĀł 2Ļ░£ ņØ┤ĒĢś; (2) ņŗ£ņāüļ®┤ņŚÉņä£ ļŗ┤ļ░░ ļ¬©ņ¢æ(cigar-shaped)ņØ┤ļ®┤ņä£ ņČĢļ®┤(axial)ņŚÉņä£ ņøÉĒśĢ, ĒāĆņøÉĒśĢ, ļśÉļŖö ņÉÉĻĖ░ļ¬©ņ¢æ(wedge-shaped); (3) ņ▓Öņłś ņŻ╝ļ│ĆļČĆ(periphery), ĻĘĖņżæņŚÉņä£ļÅä Ļ░Ćņ¬ĮĻĖ░ļæź(lateral column)Ļ│╝ ļō▒ņ¬ĮĻĖ░ļæź(dorsal column)ņŚÉ ņ£äņ╣śĒĢśļŖö Ļ│ĄĻ░äņĀü ļ░░ņŚ┤ ĒŖ╣ņä▒ņØ┤ ņ׳ļŗż(Fig. 5).23,24 ņ▓ÖņČöļČäņĀł 3Ļ░£ ņØ┤ņāü ĻĖĖņØ┤ņØ┤Ļ▒░ļéś ņ▓Öņłś ļŗ©ļ®┤ņĀü 1/2 ņØ┤ņāü ņ¦Ćļ”äņØś Ļ┤æļ▓öņ£äĒĢ£ ļ│æļ│ĆņØ┤Ļ▒░ļéś ņ▓Öņłś ņżæņŗ¼ļČĆ ĒÜīņāēņ¦łņØä ņŻ╝ļĪ£ ņ╣©ļ▓öĒĢśļŖö ļ│æļ│Ć, ņŚ░ņłśļ¦ē(leptomeningeal) ņĪ░ņśüņ”ØĻ░ĢņØ┤ ļæÉļō£ļ¤¼ņ¦ä ļ│æļ│Ć, ņ▓Öņłś ļČĆĻĖ░(swelling)Ļ░Ć ņŗ¼ĒĢ£ ļ│æļ│Ć, ļō▒ņ¬ĮĻĖ░ļæź ņäĀĒāØņĀüņØĖ ļ¦żņÜ░ ĻĖ┤ ļ│æļ│Ć, ņ▓Öņłś ņøÉļ┐ö(conus medullaris)ņŚÉ ņŻ╝ļĪ£ ĻĄŁĒĢ£ĒĢ£ ļ│æļ│ĆņØĆ NMOSD, ņŗĀĻ▓Įņé¼ļź┤ņĮöņØ┤ļō£ņ”Ø(neurosarcoidosis), Ļ░ÉņŚ╝, ņ▓Öņłśņóģņ¢æ, ņśüņ¢æĻ▓░ĒĢŹ, MOGAD Ļ░ĆļŖźņä▒ņØä ļŹö ņŗ£ņé¼ĒĢ£ļŗż.24-26
Ļ░ĆļÅīļ”¼ļŖä(gadolinium) ņĪ░ņśüņ”ØĻ░ĢņØĆ ņŻ╝ļĪ£ ņāłļĪ£ ņāØĻĖ┤ ņŚ╝ņ”Øņä▒ Ēāłņłśņ┤ł ļ│æļ│ĆņŚÉņä£ Ļ┤Ćņ░░ļÉśļ®░ ļīĆĻ░£ 2-8ņŻ╝ ņØ┤ļé┤ļĪ£ ņ¦ĆņåŹ ĻĖ░Ļ░äņØ┤ ņ¦¦ĻĖ░ ļĢīļ¼ĖņŚÉ ņśżļלļÉ£ ļ│æļ│ĆĻ│╝ņØś ĻĄ¼ļČäņŚÉ ņÜ®ņØ┤ĒĢśĻ│Ā ņŗ£Ļ░äņĀü ĒīīņóģņØä ņ×ģņ”ØĒĢśļŖö ĻĘ╝Ļ▒░ļĪ£ ĒÖ£ņÜ®ļÉĀ ņłś ņ׳ļŗż.27 ņĪ░ņśüņ”ØĻ░Ģ ĒśĢĒā£ļŖö Ļ▓░ņĀł(nodular)ņØ┤ļéś Ļ│Āļ”¼(ring) ņĪ░ņśüņ”ØĻ░Ģ ļ¬©ļæÉ ļ│┤ņØ╝ ņłś ņ׳ļŗż. ĻĘĖļ¤¼ļéś ņĪ░ņśüņ”ØĻ░Ģ ĒśĢĒā£Ļ░Ć ļ¦żņÜ░ ļ»Ėļ¦īņä▒(diffuse)ņØ┤Ļ▒░ļéś, ņŚ░ņłśļ¦ē ņĪ░ņśüņ”ØĻ░ĢņØ┤ ņ׳Ļ▒░ļéś, ĻĄŁņåī Ēö╝ņ¦łņŚÉļ¦ī ņĪ░ņśüņ”ØĻ░ĢņØ┤ ļ│┤ņØ┤Ļ▒░ļéś, ļÅÖņØ╝ĒĢ£ ļ│æļ│ĆņØ┤ 3Ļ░£ņøö ņØ┤ņāü ņ¦ĆņåŹņĀüņ£╝ļĪ£ ņĪ░ņśüņ”ØĻ░ĢņØä ļ│┤ņØ┤Ļ▒░ļéś ļ¬©ļōĀ ļ│æļ│ĆņØ┤ ļÅÖņŗ£ņŚÉ ņĪ░ņśüņ”ØĻ░ĢņØä ļ│┤ņØĖļŗżļ®┤ MSĻ░Ć ņĢäļŗÉ Ļ░ĆļŖźņä▒ņØä Ļ│ĀļĀżĒĢ┤ņĢ╝ ĒĢ£ļŗż.28,29 2010 McDonald ņ¦äļŗ© ĻĖ░ņżĆņØĆ ņä£ļĪ£ ļŗżļźĖ ļ¼┤ņ”Øņāü MRI ļ│æļ│ĆņØ┤ ņĪ░ņśüņ”ØĻ░ĢļÉśļŖö Ļ▓āĻ│╝ ņĪ░ņśüņ”ØĻ░ĢļÉśņ¦Ć ņĢŖļŖö Ļ▓āņØ┤ ļÅÖņŗ£ņŚÉ ņ׳ņØä ļĢī DITļź╝ ļ¦īņĪ▒ĒĢśļŖö Ļ▓āņ£╝ļĪ£ ļ│┤Ļ│Ā ņ”Øņāü ņ£Āļ░£ ļ│æļ│ĆņØĆ DIT ĒīÉļŗ© ņŗ£ ņĀ£ņÖĖĒĢśļÅäļĪØ ĒĢśņśĆņ£╝ļéś 2017 ņ¦äļŗ© ĻĖ░ņżĆļČĆĒä░ļŖö ņ”Øņāü ņ£Āļ░£ ļ│æļ│ĆņØś ņĪ░ņśüņ”ØĻ░ĢļÅä ļ¼┤ņ”Øņāü ļ│æļ│ĆĻ│╝ ļÅÖņØ╝ĒĢśĻ▓ī DIT ĻĖ░ņżĆņŚÉ ĒżĒĢ©ļÉśļÅäļĪØ Ļ░£ņĀĢļÉśņŚłļŗż.
ņĢ×ņä£ ņ¢ĖĻĖēĒĢ£ Ļ▓āņ▓śļ¤╝ MSĒīÉņØĆ ņĪ░ņ¦üĒĢÖņĀüņ£╝ļĪ£ ņŗ¼ļČĆņłśņ¦łņĀĢļ¦ź ņŻ╝ļ│ĆļČĆņŚÉ ņל ļ░£ņāØĒĢśļŖö ĒŖ╣ņ¦ĢņØä Ļ░Ćņ¦ĆĻ│Ā ņ׳ļŖöļŹ░ MR ņ┤¼ņśüĻĖ░ņłĀņØ┤ ļ░£ņĀäĒĢ©ņŚÉ ļö░ļØ╝ ņśüņāüņ£╝ļĪ£ MSĒīÉĻ│╝ ĒīÉņØä Ļ┤ĆĒåĄĒĢśļŖö ņŗ¼ļČĆņżæņŗ¼ņĀĢļ¦ź(central vein and venule)ņØä ņŗ£Ļ░üĒÖöĒĢĀ ņłś ņ׳Ļ▓ī ļÉśņŚłĻ│Ā ņØ┤ļź╝ ņżæņŗ¼ņĀĢļ¦źņŗĀĒśĖ(CVS)ļØ╝Ļ│Ā ļ¬ģļ¬ģĒĢśņśĆļŗż. T2*Ļ░ĢņĪ░ņśüņāü(ĒŖ╣Ē׳ T2* weighted segmented echo-planar imaging)Ļ│╝ FLAIR*ņśüņāüņŚÉņä£ ņל Ļ┤Ćņ░░ļÉśļ®░ ņ×ÉĒÖöņ£©Ļ░ĢņĪ░ņśüņāüņŚÉņä£ļÅä Ļ┤Ćņ░░ĒĢĀ ņłś ņ׳ņ£╝ļéś ņĀäņłĀĒĢ£ ņśüņāüļ│┤ļŗżļŖö CVS Ļ▓ĆņČ£ņŚÉ ņ׳ņ¢┤ ņĢĮĻ░ä ņŚ┤ļō▒ĒĢśļŗż. ņØ┤ļ¤¼ĒĢ£ ņ┤¼ņśüĻĖ░ņłĀļōżņØĆ ļ░▒ņ¦ł ļ│æļ│Ć ļé┤ņØś CVS Ļ▓ĆņČ£ņŚÉ ņśłļ»╝ĒĢśĻĖ░ ļĢīļ¼ĖņŚÉ MSņÖĆ ļ╣äMS ļ│æļ│Ć Ļ░Éļ│äņØä ņ£äĒĢ£ ņŚ░ĻĄ¼ņŚÉ ļ¦ÄņØ┤ ĒÖ£ņÜ®ļÉśņŚłĻ│Ā CVS ņ£Āļ¼┤Ļ░Ć MSņŚÉ ļ¦żņÜ░ ĒŖ╣ņØ┤ņĀüņØ┤ļØ╝ļŖö ļ│┤Ļ│ĀļōżņØ┤ ļłäņĀüļÉśĻ│Ā ņ׳ļŗż.30-32 CVSļŖö 2 mm ļ»Ėļ¦ī ņ¦üĻ▓ĮņØś Ļ░ĆļŖö ņäĀ(line) ļśÉļŖö ņĀÉ(dot) ļ¬©ņ¢æ ņĀĆņŗĀĒśĖĻ░ĢļÅäļĪ£, ņĀäĒśĢņĀüņØĖ MSĒīÉ(ņןņČĢ 3 mm ņØ┤ņāüņØś ņøÉĒśĢ ļśÉļŖö ĒāĆņøÉĒśĢņØś T2 Ļ│ĀņŗĀĒśĖĻ░ĢļÅä ļ│æļ│Ć) ĒĢ£ Ļ░ĆņÜ┤ļŹ░ļź╝ Ļ░ĆļĪ£ņ¦Ćļź┤ļŖö ļ│æļ│Ćņ£╝ļĪ£ ņĀĢņØśĒĢ£ļŗż(Fig. 6). MS ļ░▒ņ¦ł ļ│æļ│ĆņŚÉņä£ļŖö 1Ļ░£ņØś CVSļ¦ī Ļ┤Ćņ░░ļÉśļ®░ ļ¦īņĢĮ ņŚ¼ļ¤¼ Ļ░£ņØś ņĀĢļ¦źņŗĀĒśĖĻ░Ć ļ│┤ņØ┤ļ®┤ CVSļĪ£ Ļ░äņŻ╝ĒĢśņ¦Ć ņĢŖļŖöļŗż. MSļź╝ Ļ░ĢĒĢśĻ▓ī ņŗ£ņé¼ĒĢśļŖö CVS Ļ┤ĆļĀ© ĻĖ░ņżĆņØĆ ņŚ¼ļ¤¼ Ļ░Ćņ¦ĆĻ░Ć ņĀ£ņŗ£ļÉśņ¢┤ ņÖöļŖöļŹ░ (1) ņĀäņ▓┤ ļ░▒ņ¦ł ļ│æļ│ĆņØś 40% ņØ┤ņāüņŚÉņä£ CVSĻ░Ć Ļ┤Ćņ░░ļÉśļŖö Ļ▓ā, (2) ņĀäĒśĢņĀüņØĖ CVSĻ░Ć 6Ļ░£ ņØ┤ņāü Ļ┤Ćņ░░ļÉśļŖö Ļ▓ā, (3) ļ¦īņĢĮ ļ░▒ņ¦ł ļ│æļ│Ć ņ┤Ø Ļ░£ņłśĻ░Ć 6Ļ░£ ņØ┤ĒĢśļØ╝ļ®┤ ļ¬©ļōĀ ļ│æļ│ĆņŚÉņä£ CVSĻ░Ć ļ│┤ņŚ¼ņĢ╝ ĒĢśļŖö Ļ▓ā, (4) ņĀäĒśĢņĀüņØĖ CVSĻ░Ć 3Ļ░£ ņØ┤ņāü Ļ┤Ćņ░░ļÉśļŖö Ļ▓ā ļō▒ņØ┤ ņ׳ņŚłņ£╝ļ®░,30,33,34 ņ┤Ø ļ│æļ│Ć Ļ░£ņłśņØś 40% ņØ┤ņāü CVS ĻĖ░ņżĆņØä ĒÖ£ņÜ®ĒĢĀ Ļ▓ĮņÜ░ ļ╣äMSņÖĆņØś Ļ░Éļ│äņ¦äļŗ© ļ»╝Ļ░ÉļÅäļŖö 61.3%, ĒŖ╣ņØ┤ļÅäļŖö 84.1%ļĪ£ ĒÖĢņØĖļÉśņŚłļŗż.35
MS ņØ┤ĒÖś ĻĖ░Ļ░äņØ┤ ņśżļלļÉśĻ▒░ļéś ņ¦äĒ¢ēņä▒ MSņØĖ Ļ▓ĮņÜ░ ļ│æļ│Ć Ļ░Ćņןņ×Éļ”¼ņŚÉņä£ ļ¦īņä▒ ĒÖ£ļÅÖņä▒ Ēāłņłśņ┤łņÖĆ ņČĢņéŁņåīņŗżņØ┤ ņ¦ĆņåŹļÉśļ®░ ĒĢ┤ļŗ╣ ļČĆņ£äņŚÉ ļåÆņØĆ ņ▓ĀņØä ĒĢ©ņ£ĀĒĢśĻ│Ā ņ׳ļŖö(iron-enriched) CD68+ ļ»ĖņäĖņĢäĻĄÉņäĖĒżņÖĆ ļīĆņŗØņäĖĒżņØś ņ╣©ņ£żņØ┤ ļ░£Ļ▓¼ļÉśņŚłļŖöļŹ░ ņØ┤ļ¤¼ĒĢ£ ņĪ░ņ¦üĒĢÖņĀü ĒŖ╣ņ¦ĢņØ┤ ņ×ÉĒÖöņ£©ĻĖ░ļ░śņśüņāüņŚÉņä£ MSĒīÉ ņŻ╝ļ│ĆļČĆļź╝ Ļ░ÉņŗĖĻ│Ā ņ׳ļŖö ĒśĢĒā£ņØś ņĀĆņŗĀĒśĖĻ░ĢļÅä ĒģīļæÉļ”¼ļĪ£ ļ│┤ņØ┤Ļ▓ī ļÉśĻ│Ā ņØ┤ļź╝ iron-rim sign, PRL ļśÉļŖö iron-rim lesion ļō▒ņ£╝ļĪ£ ļČĆļź┤Ļ│Ā ņ׳ļŗż.36-38 ņĄ£ĻĘ╝ ņŚ░ĻĄ¼ņŚÉņä£ļŖö 39-66%ņØś MS ĒÖśņ×ÉņŚÉņä£ ņĄ£ņåī 1Ļ░£ ņØ┤ņāüņØś PRLņØ┤ Ļ┤Ćņ░░ļÉ£ļŗżĻ│Ā ĒĢśļ®░, CVSņÖĆ ļ¦łņ░¼Ļ░Ćņ¦ĆļĪ£ ņ×¼ļ░£ņÖäĒÖöĒśĢ, ņ¦äĒ¢ēĒśĢ MS ļ¬©ļæÉņŚÉņä£ Ļ┤Ćņ░░ļÉśĻ│Ā ļ╣äMSņÖĆ ĻĄ¼ļČäļÉśļŖö ņżæņÜöĒĢ£ ņśüņāüĒĢÖņĀü ĒŖ╣ņ¦Ģņ£╝ļĪ£ ņĀ£ņŗ£ļÉśĻ│Ā ņ׳ļŗż.39
MSņØś ņĀĢĒÖĢĒĢ£ ņ¦äļŗ©ņØä ņ£äĒĢ┤ņä£ļŖö McDonald ņ¦äļŗ© ĻĖ░ņżĆ ņżæ DIS, DIT ņĀĢņØśļź╝ ņל ņØ┤ĒĢ┤ĒĢśĻ│Ā ņĀĢĒÖĢĒĢśĻ▓ī ņĀüņÜ®ĒĢ┤ņĢ╝ ĒĢ£ļŗż. ļśÉĒĢ£ MS ĒŖ╣ņ¦ĢņĀüņØĖ MRI ļ│æļ│Ć ĒśĢĒā£ņÖĆ ņ£äņ╣śļź╝ ņל ņĢīĻ│Ā ņ׳ņ¢┤ņĢ╝ MSņÖĆ ņ£Āņé¼ĒĢ£ ņżæņČöņŗĀĻ▓ĮĻ│ä ņŚ╝ņ”Øņä▒ Ēāłņłśņ┤łņ¦łĒÖśĻ│╝ Ēś╝ļÅÖņØä ļ¦ēĻ│Ā ņśżņ¦äņ£©ņØä ļé«ņČ£ ņłś ņ׳ļŗż. ļ│æļ│Ć Ļ░£ņłśĻ░Ć ņĀüņØä Ļ▓ĮņÜ░ņŚÉļŖö ļ│æļ│Ć Ēü¼ĻĖ░(ņĄ£ņåī 3 mm ņØ┤ņāü), ļ¬©ņ¢æ(ĒāĆņøÉĒśĢ ļśÉļŖö ņøÉĒśĢ), ļ░░ņŚ┤(Ļ░Ćņ¬Į ļćīņŗż ĻĖ░ņżĆ ņłśņ¦üļ░®Ē¢ź)ņØ┤ MSņŚÉ ļČĆĒĢ®ĒĢśļŖöņ¦Ć ņé┤ĒÄ┤ļ│┤Ļ│Ā, ļ│æļ│Ć Ļ░£ņłśĻ░Ć ļ¦ÄņØä Ļ▓ĮņÜ░ņŚÉļŖö ļ│æļ│Ć ņ£äņ╣śņÖĆ ļČäĒżĻ░Ć MSņŚÉ ļČĆĒĢ®ĒĢśļŖöņ¦Ć ņé┤ĒÄ┤ļ│┤ļŖö Ļ▓ī ļÅäņøĆņØ┤ ļÉĀ ņłś ņ׳ļŗż.10 ļ¦łņ¦Ćļ¦ēņ£╝ļĪ£ CVSņÖĆ PRLņØĆ ņāłļĪŁĻ▓ī ļČĆņāüĒĢśĻ│Ā ņ׳ļŖö MSņØś MRI ĒŖ╣ņ¦ĢņØ┤ļ»ĆļĪ£ ņØ┤ņŚÉ ļīĆĒĢ┤ ņל ņØ┤ĒĢ┤ĒĢ┤ļæÉĻ│Ā Ē¢źĒøä ņ¦äļŗ© ĻĖ░ņżĆņŚÉ ĒżĒĢ©ļÉśļŖöņ¦Ć ņ¦Ćņ╝£ļ│╝ ĒĢäņÜöĻ░Ć ņ׳Ļ▓Āļŗż.
Figure┬Ā1.
Examples of periventricular white matter lesions as referred to as dissemination in a space in the McDonald criteria. (A) White matter lesions in direct contact with the lateral ventricle without intervention in the normal white matter. (B) Characteristic periventricular white matter lesions which abut perpendicularly to the main axis of the lateral ventricles referred to as DawsonŌĆÖs fingers.

Figure┬Ā2.
Conditions mimicking periventricular white matter lesions of multiple sclerosis. (A) Periventricular capping is usually a nonspecific aging-related lesion. (B) Small, punctate white matter lesions in patients with a history of migraine or cerebral ischemic small-vessel disease.
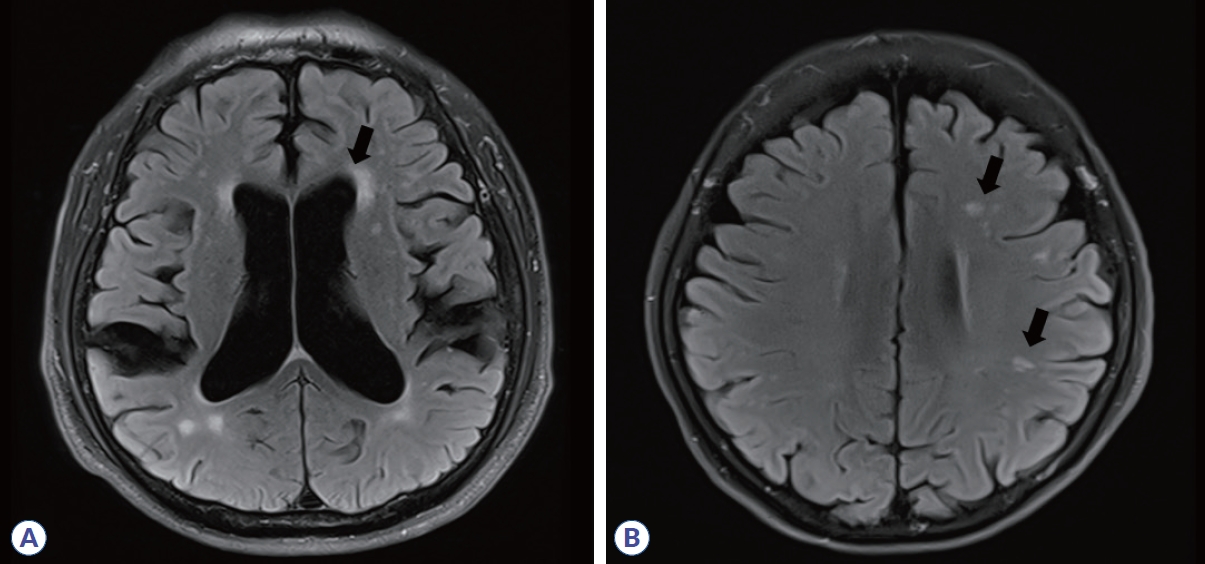
Figure┬Ā3.
Juxtacortical/cortical lesions, which are referred to as dissemination in space in the McDonald criteria (images courtesy of Professor Su-Hyun Kim). (A) Multiple sclerosis lesion involving subcortical U-fibers (blak arrow). (B) Intracortical lesion of multiple sclerosis in a double inversion recovery sequence (yellow arrow).
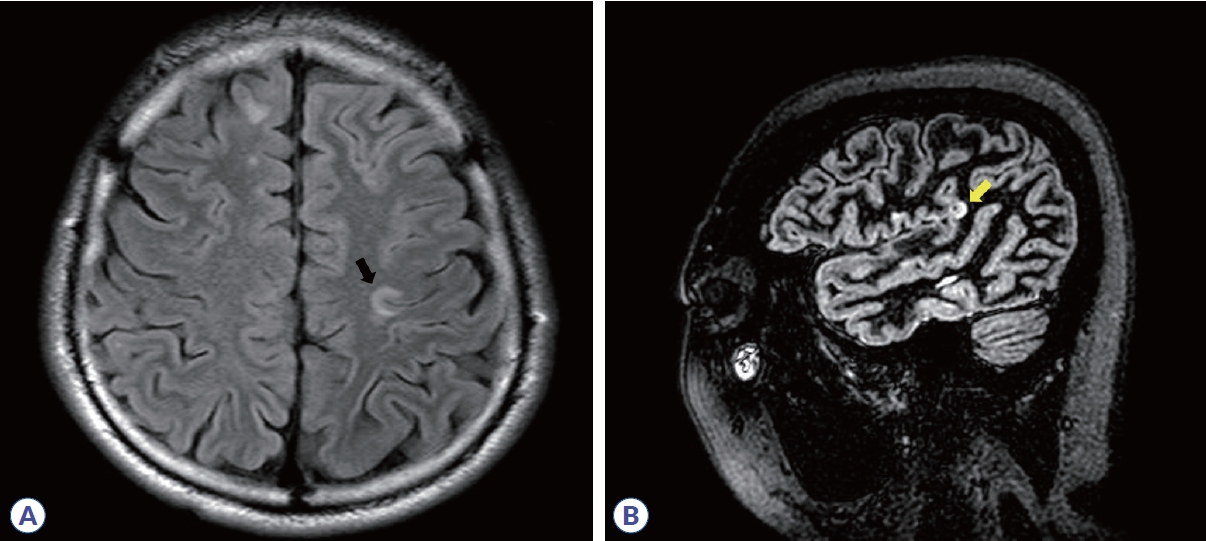
Figure┬Ā4.
Infratentorial lesions in multiple sclerosis and its mimics. (A) Lesion involving the pontine trigeminal root entry zone in multiple sclerosis (yellow arrow). (B) Central pontine lesion in cerebral ischemic small-vessel disease (yellow arrow). (C) Lesion involving the postrema of the medulla oblongata in neuromyelitis optica spectrum disorder (yellow arrow). (D) Middle cerebellar peduncle lesion in anti-myelin oligodendrocyte glycoprotein-antibody disease (yellow arrow).
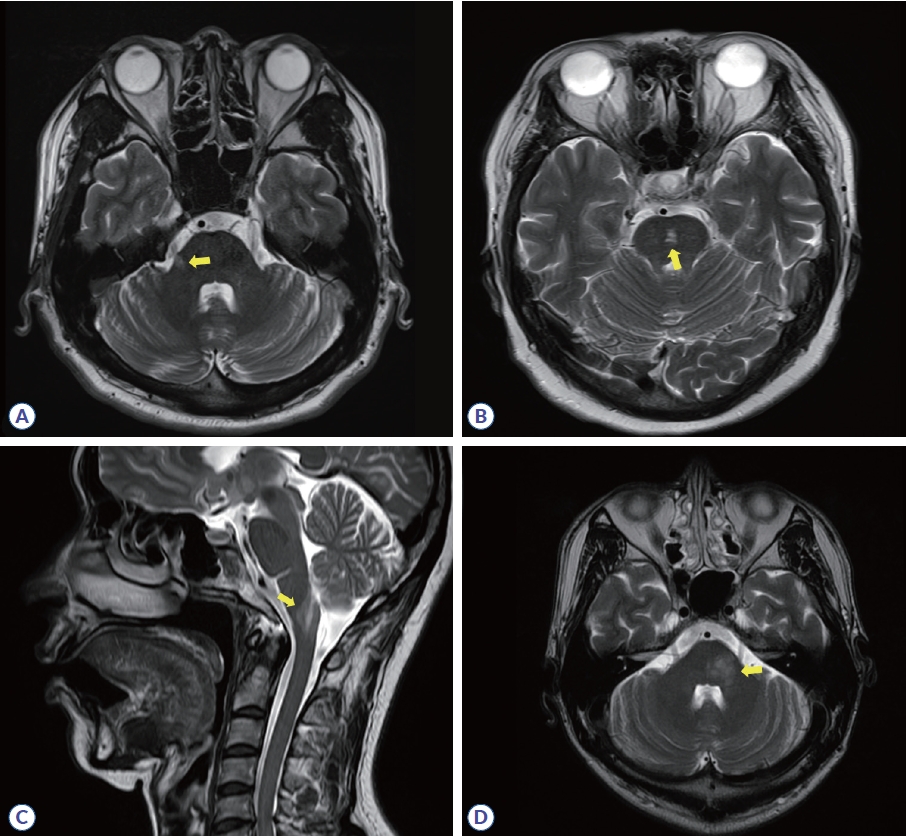
Figure┬Ā5.
Spinal cord lesions suggestive of multiple sclerosis, which are round/ovoid or wedge shaped, peripherally located, and cigar-shaped in the sagittal plane (red arrows). The same colored arrow indicates the same lesion in a different plane (red and yellow arrows).
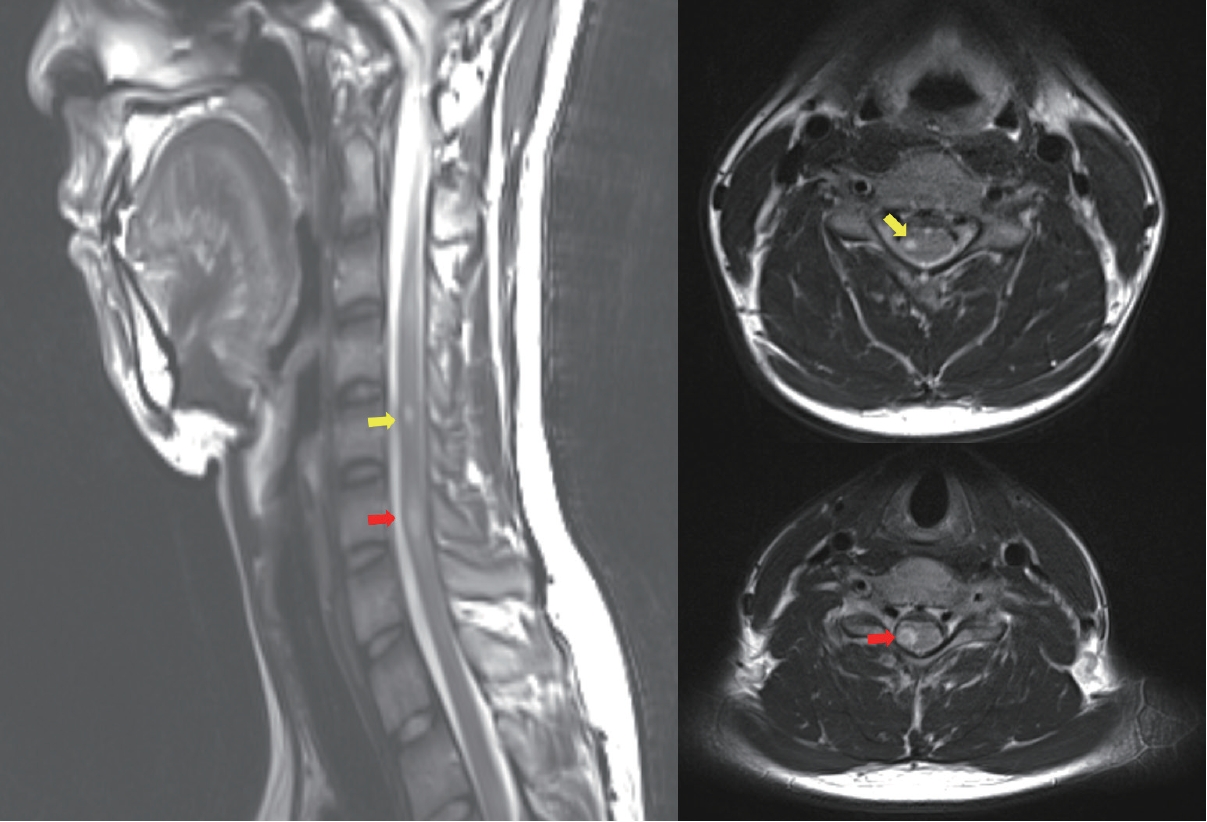
Figure┬Ā6.
Examples of central vein sign. T2-hyperintense signal in the fluid-attenuated inversion recovery sequence (left image) and a thin, linear-shaped paramagnetic signal that runs centrally through the corresponding T2 lesion (right image) in conventional susceptibility-weighted imaging (courtesy of Professor Su-Hyun Kim). FLAIR, fluid-attenuated inversion recovery; SWI, susceptibility weighted imaging.
REFERENCES
1. Schumacher GA, Beebe G, Kibler RF, Kurland LT, Kurtzke JF, McDowell F, et al. Problems of experimental trials of therapy in multiple sclerosis: report by the panel on the evaluation of experimental trials of therapy in multiple sclerosis. Ann N Y Acad Sci 1965;122:552-568.


2. Poser CM, Paty DW, Scheinberg L, McDonald WI, Davis FA, Ebers GC, et al. New diagnostic criteria for multiple sclerosis: guidelines for research protocols. Ann Neurol 1983;13:227-231.


3. McDonald WI, Compston A, Edan G, Goodkin D, Hartung HP, Lublin FD, et al. Recommended diagnostic criteria for multiple sclerosis: guidelines from the International Panel on the diagnosis of multiple sclerosis. Ann Neurol 2001;50:121-127.


4. Polman CH, Reingold SC, Banwell B, Clanet M, Cohen JA, Filippi M, et al. Diagnostic criteria for multiple sclerosis: 2010 revisions to the McDonald criteria. Ann Neurol 2011;69:292-302.




5. Thompson AJ, Banwell BL, Barkhof F, Carroll WM, Coetzee T, Comi G, et al. Diagnosis of multiple sclerosis: 2017 revisions of the McDonald criteria. Lancet Neurol 2018;17:162-173.


6. Brownlee WJ, Swanton JK, Altmann DR, Ciccarelli O, Miller DH. Earlier and more frequent diagnosis of multiple sclerosis using the McDonald criteria. J Neurol Neurosurg Psychiatry 2015;86:584-585.



7. Solomon AJ, Bourdette DN, Cross AH, Applebee A, Skidd PM, Howard DB, et al. The contemporary spectrum of multiple sclerosis misdiagnosis: a multicenter study. Neurology 2016;87:1393-1399.



8. Kaisey M, Solomon AJ, Luu M, Giesser BS, Sicotte NL. Incidence of multiple sclerosis misdiagnosis in referrals to two academic centers. Mult Scler Relat Disord 2019;30:51-56.


9. Brownlee WJ, Hardy TA, Fazekas F, Miller DH. Diagnosis of multiple sclerosis: progress and challenges. Lancet 2017;389:1336-1346.


10. Filippi M, Preziosa P, Banwell BL, Barkhof F, Ciccarelli O, De Stefano N, et al. Assessment of lesions on magnetic resonance imaging in multiple sclerosis: practical guidelines. Brain 2019;142:1858-1875.




11. Adams CW, Poston RN, Buk SJ. Pathology, histochemistry and immunocytochemistry of lesions in acute multiple sclerosis. J Neurol Sci 1989;92:291-306.


12. Liu S, Kullnat J, Bourdette D, Simon J, Kraemer DF, Murchison C, et al. Prevalence of brain magnetic resonance imaging meeting Barkhof and McDonald criteria for dissemination in space among headache patients. Mult Scler 2013;19:1101-1105.



13. Wardlaw JM, Smith EE, Biessels GJ, Cordonnier C, Fazekas F, Frayne R, et al. Neuroimaging standards for research into small vessel disease and its contribution to ageing and neurodegeneration. Lancet Neurol 2013;12:822-838.



14. Triplett JD, Qiu J, O'Brien B, Gopinath S, Trewin B, Spring PJ, et al. Diagnosis, differential diagnosis and misdiagnosis of Susac syndrome. Eur J Neurol 2022;29:1771-1781.




15. Garg N, Reddel SW, Miller DH, Chataway J, Riminton DS, Barnett Y, et al. The corpus callosum in the diagnosis of multiple sclerosis and other CNS demyelinating and inflammatory diseases. J Neurol Neurosurg Psychiatry 2015;86:1374-1382.


16. Kim HJ, Paul F, Lana-Peixoto MA, Tenembaum S, Asgari N, Palace J, et al. MRI characteristics of neuromyelitis optica spectrum disorder: an international update. Neurology 2015;84:1165-1173.



17. Wang KY, Chetta J, Bains P, Balzer A, Lincoln J, Uribe T, et al. Spectrum of MRI brain lesion patterns in neuromyelitis optica spectrum disorder: a pictorial review. Br J Radiol 2018;91:20170690.



18. B├Ė L, Vedeler CA, Nyland HI, Trapp BD, M├Ėrk SJ. Subpial demyelination in the cerebral cortex of multiple sclerosis patients. J Neuropathol Exp Neurol 2003;62:723-732.


19. Sethi V, Muhlert N, Ron M, Golay X, Wheeler-Kingshott CA, Miller DH, et al. MS cortical lesions on DIR: not quite what they seem? PLoS One 2013;8:e78879.



20. Filippi M, Rocca MA, Ciccarelli O, De Stefano N, Evangelou N, Kappos L, et al. MRI criteria for the diagnosis of multiple sclerosis: MAGNIMS consensus guidelines. Lancet Neurol 2016;15:292-303.



21. Banks SA, Morris PP, Chen JJ, Pittock SJ, Sechi E, Kunchok A, et al. Brainstem and cerebellar involvement in MOG-IgG-associated disorder versus aquaporin-4-IgG and MS. J Neurol Neurosurg Psychiatry 2021;92:384-390.

22. Ko├¦er N, Islak C, Siva A, Saip S, Akman C, Kantarci O, et al. CNS involvement in neuro-Beh├¦et syndrome: an MR study. AJNR Am J Neuroradiol 1999;20:1015-1024.


23. Lycklama G, Thompson A, Filippi M, Miller D, Polman C, Fazekas F, et al. Spinal-cord MRI in multiple sclerosis. Lancet Neurol 2003;2:555-562.


24. Ciccarelli O, Cohen JA, Reingold SC, Weinshenker BG, International Conference on Spinal Cord Involvement and Imaging in Multiple Sclerosis and Neuromyelitis Optica Spectrum Disorders. Spinal cord involvement in multiple sclerosis and neuromyelitis optica spectrum disorders. Lancet Neurol 2019;18:185-197.

25. Dubey D, Pittock SJ, Krecke KN, Morris PP, Sechi E, Zalewski NL, et al. Clinical, radiologic, and prognostic features of myelitis associated with myelin oligodendrocyte glycoprotein autoantibody. JAMA Neurol 2019;76:301-309.


26. Geraldes R, Ciccarelli O, Barkhof F, De Stefano N, Enzinger C, Filippi M, et al. The current role of MRI in differentiating multiple sclerosis from its imaging mimics. Nat Rev Neurol 2018;14:199-213.



27. Rovira ├Ć, Wattjes MP, Tintor├® M, Tur C, Yousry TA, Sormani MP, et al. Evidence-based guidelines: MAGNIMS consensus guidelines on the use of MRI in multiple sclerosis-clinical implementation in the diagnostic process. Nat Rev Neurol 2015;11:471-482.



28. Charil A, Yousry TA, Rovaris M, Barkhof F, De Stefano N, Fazekas F, et al. MRI and the diagnosis of multiple sclerosis: expanding the concept of "no better explanation". Lancet Neurol 2006;5:841-852.


29. Miller DH, Weinshenker BG, Filippi M, Banwell BL, Cohen JA, Freedman MS, et al. Differential diagnosis of suspected multiple sclerosis: a consensus approach. Mult Scler 2008;14:1157-1174.




30. Mistry N, Abdel-Fahim R, Samaraweera A, Mougin O, Tallantyre E, Tench C, et al. Imaging central veins in brain lesions with 3-T T2*-weighted magnetic resonance imaging differentiates multiple sclerosis from microangiopathic brain lesions. Mult Scler 2016;22:1289-1296.



31. Sati P, Oh J, Constable RT, Evangelou N, Guttmann CR, Henry RG, et al. The central vein sign and its clinical evaluation for the diagnosis of multiple sclerosis: a consensus statement from the North American Imaging in Multiple Sclerosis Cooperative. Nat Rev Neurol 2016;12:714-722.



32. Ontaneda D, Sati P, Raza P, Kilbane M, Gombos E, Alvarez E, et al. Central vein sign: a diagnostic biomarker in multiple sclerosis (CAVS-MS) study protocol for a prospective multicenter trial. Neuroimage Clin 2021;32:102834.



33. Tallantyre EC, Dixon JE, Donaldson I, Owens T, Morgan PS, Morris PG, et al. Ultra-high-field imaging distinguishes MS lesions from asymptomatic white matter lesions. Neurology 2011;76:534-539.



34. Solomon AJ, Watts R, Ontaneda D, Absinta M, Sati P, Reich DS. Diagnostic performance of central vein sign for multiple sclerosis with a simplified three-lesion algorithm. Mult Scler 2018;24:750-757.




35. Sinnecker T, Clarke MA, Meier D, Enzinger C, Calabrese M, De Stefano N, et al. Evaluation of the central vein sign as a diagnostic imaging biomarker in multiple sclerosis. JAMA Neurol 2019;76:1446-1456.



36. Kaunzner UW, Kang Y, Zhang S, Morris E, Yao Y, Pandya S, et al. Quantitative susceptibility mapping identifies inflammation in a subset of chronic multiple sclerosis lesions. Brain 2019;142:133-145.



37. Absinta M, Sati P, Fechner A, Schindler MK, Nair G, Reich DS. Identification of chronic active multiple sclerosis lesions on 3T MRI. AJNR Am J Neuroradiol 2018;39:1233-1238.



-
METRICS

-
- 0 Crossref
- 0 Scopus
- 10,064 View
- 89 Download
- Related articles
-
Disability Measurement in Multiple Sclerosis: Beyond EDSS2025 December;16(2)
Proposal of Standard MRI Protocol for Multiple Sclerosis and Neuromyelitis Optica2011 March;2(1)
Advanced MRI techniques in Multiple Sclerosis2013 September;4(2)
Healthcare Costs of Multiple Sclerosis in Korea According to the Level of Disability2015 March;6(1)



 PDF Links
PDF Links PubReader
PubReader ePub Link
ePub Link Full text via DOI
Full text via DOI Download Citation
Download Citation Print
Print