한국인 재발 완화 다발성경화증 환자에서 고효능 질병 조절 치료제 사용의 최신 패턴
Contemporary Patterns of High-Efficacy Disease Modifying Therapy Use in Korean Patients with Relapsing-Remitting Multiple Sclerosis
Article information
Trans Abstract
Background
Despite the compelling evidence indicating that early initiation of high-efficacy disease modifying therapies (DMTs) is more effective in controlling disease activity and preventing long-term disability in relapsing-remitting multiple sclerosis (RRMS), there is a scarcity of data regarding the implementation of such treatments in Korea. This study aimed to investigate the actual proportion of patients requiring high-efficacy DMT when disease activity is closely monitored.
Methods
We conducted a retrospective analysis of medical records of 104 patients with RRMS who developed their disease after 2015 at the National Cancer Center in Korea. The status of no evidence of disease activity-3 (NEDA-3) was defined as no relapse, disability progression, or active lesions in annual magnetic resonance imaging evaluations.
Results
Among 104 RRMS patients, 95 started with moderate-efficacy DMT, and nine with high-efficacy DMT. Of patients, 51% showed disease activity despite moderate-efficacy DMT, and prompting 41% to escalate high-efficacy DMT with a median time to switch of 20 months. Following the switch to a high-efficacy DMT, NEDA-3 was maintained in 82% of patients for a median of 27 months (interquartile range: 22, 45). Among the nine patients initially on high-efficacy DMT, no patient exhibited any signs of disease activity after median 34 months of treatment. The majority of patients experienced no significant side effects of high-efficacy DMT.
Conclusion
The study showed a significant number of patients requiring escalation to high-efficacy DMT within a few years of treatment initiation with moderate-efficacy DMT, emphasizing the importance of early intervention strategies in managing the patients.
서론
다발성경화증(multiple sclerosis)의 치료 환경 및 전략은 최근 20년 동안 빠르게 변화하고 있다. 1990년대 중반 다발성경화증질환 조절 치료(disease modifying therapy, DMT)로서 자가주사 치료제인 인터페론 베타가 처음 사용된 이후 2010년대에 환자의 약물 순응도를 높이기 위한 경구 약제가 개발되고, 질환의 병리에 보다 특이적으로 작용하여 질환 조절효과를 높이기 위한 약제들이 빠르게 개발되면서 현재는 약 20개의 약제가 미국 Food and Drug Administration 및 European Medicines Agency의 승인을 받아 널리 사용되고 있다. 2018년 발표한 유럽과 미국의 치료 가이드라인에 따르면 높은 질환 활성도를 보이는 환자는 처음부터 고효능 약물(high-efficacy DMT)로 치료 시작을 권고하고, 중등도의 질환 활성도를 보이는 재발 이장성 다발성경화증(relapsing-remitting multiple sclerosis) 환자는 일차로 중등도의 효능 약물(moderate-efficacy DMT; 인터페론 베타[interferon-beta], 글라티라머 아세테이트[glatiramer acetate], 테리플루노마이드[teriflunomide], 디메틸 퓨마레이트[dimethyl fumarate])로 시작하다가 질환 활성도가 관찰되는 경우에 고효능 치료제(high-efficacy therapy; 핑고리모드[fingolimod], 나탈리주맙[natalizumab], 클라드리빈[cladribine], 알렘투주맙[alemtuzumab], 오크렐리주맙[ocrelizumab], 오파투무맙[ofatumumab], 리툭시맙[rituximab])로 전환하는 단계적 격상 치료전략(escalation strategy)이 권고되었다.1,2
국내에서는 2015년 말 나탈리주맙을 시작으로, 알렘투주맙(2015년 10월), 핑고리모드(2017년 6월), 클라드리빈(2020년 8월)의 고효능 약물들이 요양보험 급여로 사용 가능하게 되었다. 저자들은 2019년에 국내의 4개 병원의 신경과에서 2017년 7월까지 추적 중이던 임상적 단독 증후군(clinically isolated syndrome) 및 재발 완화 다발성경화증 환자들을 대상으로 질환 조절 치료효과에 대해 보고하였다.3 전체 150명의 환자에서 약 5.7년의 치료 기간 동안 치료 전과 비교하여 유의한 재발률의 감소가 관찰되었고, 21%의 환자가 중등도 효능 약물 치료 중 불충분한 치료효과 때문에 치료 시작 평균 1.4년 후에 고효능 약물로 전환을 하였다. 하지만 국내에서 2016년까지 고효능 약물이 사용이 불가능하여 국내의 신경과 전문의들이 이러한 고효능 약물 경험이 없었던 것을 고려하면, 당시 연구에 포함되었던 대다수의 환자들은 중등도 효능 약물 시작 후 질환 활성도가 관찰되어도 적극적으로 고효능 약물로 전환하는 것이 어려운 상황이었기 때문에 단계적 격상 치료가 지연되거나 이뤄지지 않는 상황이 발생할 수밖에 없는 환자들이었다. 또한 과거에는 추적 MRI 검사 간격도 표준화되어 있지 않아 MRI 모니터링 간격이 1-3년으로 일정하지 않고 면밀하게 시행되지 않았던 한계가 있었다.
이에 본 연구에서는 2015년 이후에 발병한 환자들을 대상으로 유럽과 미국 가이드라인에 따라 적어도 1년에 한 번 뇌 MRI를 면밀히 모니터하고, 질환 활성도가 관찰되는 경우 고효능 약물로 전환하였을 때 한국인 다발성경화증 환자에서 고효능 약물의 사용 빈도 및 그 시기에 대해 조사해보고자 하였다.
대상과 방법
이 연구는 2015년 이후에 발병하여 국립암센터 다발성경화증 클리닉에 방문한 재발 완화 다발성경화증(relapsing-remitting multiple sclerosis)을 대상으로 하였다. 2017년 맥도날드 기준4에 따라 진단된 총 152명의 재발 완화 다발성경화증 환자 중 치료 기간 1년 미만(10명), 외국인(8명), 임상 연구 참여(14명), 추적 관찰 중단 환자(16명)를 제외하고, 104명이 본 연구에 등록되었다. 등록된 환자의 발병 나이, 성별, 임상적인 특징 및 치료 이력(발병 임상 양상, 치료 시작 시기, 치료제 종류, 치료 전후 재발 빈도, 치료 전후 Expanded disability Status Score [EDSS]), MRI 소견(초기 T2 강조 MRI에서 10개 이상의 고강도 병변, 뇌간 및 소뇌 병변, 조영증강 병변 및 척수 이상 소견 유무 및 후속 MRI에서 새로운/확대된 T2 강조 병변 또는 가돌리늄 조영증강 병변이 있는지 여부) 및 뇌척수액 올리고클로날 밴드(oligoclonal band) 유무 대한 의무기록 조사를 시행하였다. 본 연구는 국립암센터 윤리위원회로부터 승인을 받았다(IRB 번호: NCC2014-0146).
연구에 등록된 모든 환자는 질환 조절 치료 중 뇌 MRI는 0.5-1년마다 실시하였으며, 치료 중 재발, 장애 진행 또는 MRI상 새로운 병변/크기 증가 병변 세 가지 조건이 없을 때 질환 활성도의 근거가 없는 상태-3 (no evidence of disease activity-3, NEDA-3)를 만족하는 것으로 하였다.5 이 세 가지 조건 중 한 가지라도 관찰되는 경우 질환 활성도의 근거가 있는 것(evidence of disease activity-3, EDA-3)으로 정의하였다. MRI는 3.0테슬라 스캐너(Philips Achieva; Philips Medical Systems, Best, Netherlands)를 사용하여 수행되었으며 슬라이스 두께는 3 mm로 검사되었다. MRI 스캔은 T1 및 T2강조 영상, FLAIR 영상, 가돌리늄 강조를 사용한 T1강조 영상으로 구성되었다. 다발성경화증 재발은 24시간 이상 지속되는 신경학적 기능 장애 증상의 발생, 재발 또는 악화로 정의되었다.6 장애 진행은 기준 EDSS 점수에 따라 정의되었다: 기준 EDSS 점수가 0-1.0인 경우는 최소 1.5점, 1.0-5.0인 경우는 최소 1점, 5.0 이상인 경우 0.5점 이상 증가 시 장애 진행을 만족하는 것으로 하였다.7 현재 국내에서 급여 사용 승인된 약물 중 인터페론 베타, 글라티라머아세테이트, 테리플루노마이드, 디메틸 퓨마레이트는 중등도 효능 약물로, 핑고리모드, 나탈리주맙, 클라드리빈, 알렘투주맙은 고효능 약물로 분류하였다. 중등도 효능에서 고효능 약물로의 전환은 유럽과 미국의 가이드라인에 따라 1번 이상의 재발 또는 MRI상 2개 이상의 새로이 발생한 또는 크기가 증가한 T2 병변 또는 임상적인 장애의 진행이 있는 경우에 시행하였다1,2
연속형 변수에는 기술 통계, 예를 들어 평균±표준편차 값 또는 중위값과 사분위수 범위(interquartile range, IQR)를 사용하였고, 범주형 변수는 각 그룹에 속한 피험자의 수와 백분율로 설명하였다. 중등도 효능 약물 치료 중 NEDA-3 유무에 따라 임상적 특징의 비교는 Mann-Whitney 테스트를 사용하였다. 모든 분석에는 STATA SE 소프트웨어(버전 10.0; Stata-Corp., College Station, TX, USA)가 사용되었고, 0.05 미만의 양면 p값은 통계적으로 유의미한 것으로 평가하였다.
결과
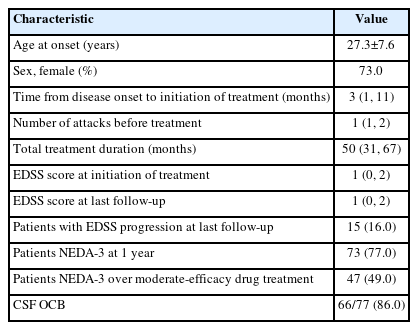
총 104명의 재발 완화 다발성경화증 환자들이 연구에 등록되었고, 이 중 95명은 중등도 효능 약물로 치료를 시작하였고, 9명은 고효능 약물로 치료를 시작하였다. 중등도 효능 약물로 시작한 95명의 임상적 특징은 Table 1에 기재하였다. 95명 중 73명(77%)이 국립암센터에 방문하여 첫 질환 조절 치료를 시행하였고, 14명(15%)은 중등도 효능 약물을 시작한지 6개월 이내에 방문한 환자였다. 질환 발병으로부터 국립암센터 방문까지의 시간의 중앙값은 4개월(IQR: 1, 19)이었고, 질환 발병으로부터 질환 조절 치료의 첫 시작의 중앙값은 3개월(IQR: 1, 11)이었다. 발병 후 6개월 이내에 치료를 시작한 환자는 67명(71%)이었다. 질환 조절 치료 시작할 때의 EDSS 점수의 중앙값은 1 (IQR: 0, 2)이었고, 73명(77%)은 자가주사약물로, 22명(23%)은 경구약물로 치료를 시작하였다. 중등도 효능 약물 시작 후 NEDA-3를 유지한 환자는 47명(49%)이었고, 치료 첫 1년간 NEDA-3를 유지한 환자는 73명(77%)이었다. 전체 환자의 48명(51%)은 중등도 효능 약물 치료 중 중앙값 16개월(IQR: 6, 29) 만에 재발, MRI상 새로운 병변 또는 장애의 진행이 관찰되었고, 39명(41%)은 고효능 약물로 전환하였는데, 이 환자들에서 중등도 효능 약물 시작 후 전환까지의 기간 중앙값은 20개월(IQR: 11, 36)이었다. 중등도 효능 약물 치료 중 33명의 환자에서 44번의 재발이 있었고, 13명은 재발 없이 MRI상 질환 활성도 때문에 약물을 변경하였다. 질환 활성도가 관찰되었지만, 고효능 약물로 전환하지 않은 9명의 환자 중 4명은 1번의 재발이 있었고, 5명은 MRI상에서만 질환 활성도가 관찰되었다. 5명은 자가주사약물에서 디메틸 퓨마레이트로 변경하였고, 나머지 4명 환자들은 약물 변경을 원하지 않아서 좀 더 경과 관찰 후 약물 변경을 고려하기로 하였다.
고효능 약물로 전환한 39명의 환자는 각각 클라드리빈 19명, 핑고리모드 12명, 나탈리주맙 6명, 알렘투주맙 2명으로 약물을 변경하였다. 고효능 약물 변경 후 고효능 약물 사용 6개월 미만인 6명을 제외하고, 치료 기간 중앙값 27개월(IQR: 22, 45) 동안 33명 중 27명(82%)이 NEDA-3를 유지하였다. 8명의 환자가 고효능 약물로 치료를 받는 동안 약제를 전환하였다: 2명의 환자가 클라드리빈 치료 중 재발 때문에 나탈리주맙으로 치료 전환하였고, 1명의 환자가 핑고리모드 사용 중 MRI상 질환 활성도를 보여 나탈리주맙으로 전환하였고, 1명의 환자는 나탈리주맙 연관 아나필락토이드 반응으로 클라드리빈으로 전환, 1명의 환자는 핑고리모드 사용 후 질환이 안정되었으나, 임신을 위해서 글라티라머 아세테이트로 변경하였다가 질환 활성도가 다시 관찰되어 클라드리빈으로 변경, 3명의 나탈리주맙 치료 환자는 2년 후 진행성 다초점성 백질병증(progressive multifocal leukoencephalopathy) 위험성 때문에 핑고리모드 또는 디메틸 퓨마레이트로 전환하였다. 고효능 약물을 사용하는 동안 유의한 감염이나 부작용은 관찰되지 않았다. 중등도 효능 약물로 시작한 95명중 15명(16%)에서 마지막 추적관찰 시 치료 시작 시점과 비교하여 장애의 진행이 확인되었다.
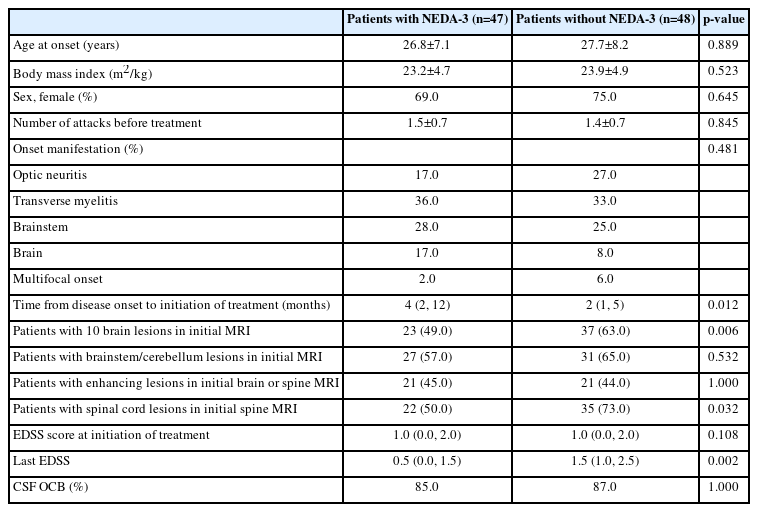
중등도 효능 약물 사용 후 질환 활성도 유무에 따라 임상적 특징을 비교하였을 때 질환의 발병에서부터 치료 시작까지의 기간이 NEDA-3를 보였던 그룹(4개월)에서 EDA-3를 보인 그룹에 비해(2개월) 약간 길었다(p=0.012) (Table 2). 치료 중 EDA-3를 보였던 그룹에서 질환 발병 당시 뇌 MRI상 병변이 10개 이상인 환자(p=0.006) 및 척수 MRI상 병변이 있었던 환자 비율(p=0.032) 그리고 마지막 치료 후 EDSS 점수(p=0.002)가 NEDA-3를 보인 그룹보다 높았다. 그 외 발병 나이, 성별, 발병 당시 임상적 발현 양상, 치료 시작 시 EDSS 점수 및 뇌척수액내 올리고클로날 밴드 양성률은 차이가 관찰되지 않았다.
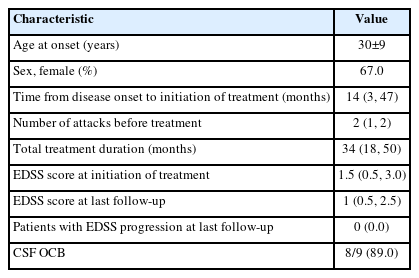
9명의 환자는 고효능 약물을 일차 치료로 사용하였는데, 평균 발병 나이는 30±9세, 치료 전 재발 횟수는 1.7±0.5, 치료 시작 시 EDSS 점수의 중앙값은 1.5 (IQR: 0.5, 3.0)였다(Table 3). 발병 후 치료 시작까지의 기간의 중앙값은 14개월(IQR: 3, 47)이었으며, 고효능 약물 치료 기간의 중앙값 34개월(IQR: 18, 50) 동안 질환 활성도가 관찰된 환자는 없었다. 7명의 환자가 핑고리모드로 치료를 시작하였으며, 2명은 나탈리주맙으로 치료를 시작하였다. 핑고리모드 치료 중 1명의 환자가 중증 림프구 감소증 때문에 치료 7개월만에 디메틸 퓨마레이트로 전환하였으나, 치료 1년째 MRI상 조영증강 병변이 3개 이상 관찰되어 클라드리빈으로 다시 변경하여 유지 중이었고, 나탈리주맙으로 치료 시작한 1명이 치료 2년 후 진행성 다초점성 백질병증 위험 때문에 디메틸 퓨마레이트로 전환하였다. 핑고리모드로 시작한 1명의 환자는 3년 이상 NEDA-3를 유지 후 임신을 위해 글라티라머 아세테이트로 전환 후 임신을 시도 중이었다. 그 외 다른 부작용이나 약제의 변경은 없었다.
고찰
본 연구에서 2015년 이후 발병한 환자들을 대상으로 최신 가이드라인에 따른 질환의 모니터링과 치료를 시행하였을 때 51%의 환자가 중등도 효능의 약물로 치료함에도 불구하고, 질환 활성도가 관찰되고, 41%의 환자가 치료 20개월만에 고효능 치료제로 전환하였다. 진단 당시 고효능 약물로 시작한 9명의 환자까지 고려하면 총 104명 중 48명(46%)이 고효능 약물로 치료를 하고 있었다. 본 연구의 약 70%의 환자가 발병 후 6개월 이내에 질환 조절 치료를 시작하고 발병 후 치료 시작까지의 기간의 중위값이 3개월인 것을 고려하면, 조기에 진단 후 치료를 시작해도 약 절반의 국내 재발 완화 다발성경화증 환자는 중등도 효능 약물의 불충분한 치료 효과로 인해 수년 이내 고효능 약물로의 전환이 필요하다는 것을 시사한다. 이는 이전에 2017년 7월까지 추적 중이던 국내의 다발성경화증 환자를 대상으로 한 연구에서 평균 치료 5.7년 동안 21%의 환자가 고효능 약물로 전환하였다는 결과와 비교할 때3 거의 두배나 많은 환자 숫자로, 과거 국내의 상당수의 환자들이 불충분한 치료를 받았을 가능성이 있다는 것을 의미한다. 본 연구의 결과는 앞선 서구의 연구들에서 증등도 효능 약물로 치료 시작 시 60% 이상의 환자가 치료 2년 이내 질환 활성도를 보이고, 스위스와 덴마크에서는 고효능 약물의의 실제 사용 빈도가 각각 56%, 33%라는 결과들과도 일치한다.8-10
중등도 효능 약물 치료 후 NEDA-3를 보인 그룹과 EDA-3를 보인 그룹을 비교하였을 때 발병 후 치료 시작까지의 기간은 질환 활성도를 보인 그룹에서 NEDA-3를 보인 그룹보다 2개월이 짧았다. 하지만 두 그룹 모두 발병 후 치료 시작까지의 기간이 6개월 미만으로 짧은 것을 고려할 때 이러한 치료 시작 기간의 차이가 치료 후 질환 활성도라는 결과에 영향을 미쳤다기보다는 발병 당시 질환 활성도가 높았던 환자에서 약물을 좀 더 일찍 시작했을 가능성이 높고, 이는 치료 시작 후 불충분한 질환 조절 효과로 이어진 것으로 보인다. EDA-3를 보인 그룹에서 발병 당시 보다 높은 질환 활성도를 시사하는 뇌 MRI에서 10개 이상의 병변 및 척수 MRI상 병변이 있었던 환자들이 더 많았다는 것이 이를 뒷받침한다. 발병 당시 MRI상 많은 뇌 병변이 중등도 효능 약물 치료 시 불충분한 효과를 예측할 수 있다는 것은 이전 연구들과 일치하는 결과이다.3,11-13
고효능 약물로 치료 전환한 환자들은 평균 27개월 동안 82%의 환자가 NEDA-3를 유지하였고, 나탈리주맙에 아나필락토이드 반응을 보여 변경한 환자를 제외하고는 약물 중단을 요하는 부작용은 관찰되지 않았다. 또한 고효능 약물로 치료를 시작한 9명의 환자들은 발병 후 치료 시작까지 약 14개월로 중등도 효능 약물로 시작한 환자들과 비교하여 조금 지연된 치료 시작이 있었지만, 약 34개월의 치료 기간 동안 질환 활성도를 보인 환자는 없었으며, 대부분의 환자가 유의한 부작용 없이 치료에 잘 적응하였다. 이러한 결과는 고효능 약물이 보다 높은 질환 조절효과로서 장기적인 장애 진행 위험을 낮출 수 있다는 것을 뒷받침한다. 2010년대 초중반 고효능 약물들이 서구에서 먼저 승인되어 사용되기 시작하였을 때 중등도 효능 약물들과 비교하여 부작용 위험성을 염려하였지만, 이후 보다 많은 수의 환자를 대상으로 한 시판 후 자료들에서 예방 백신 및 세심한 치료 모니터링 전략을 통해 고효능 약물들의 장기적인 약물 안전성 및 높은 약물 순응도가 보고되고 있다.14-17 게다가 치료 중 다발성경화증 질환 환성도 모니터링을 위한 현재의 임상적, 영상학적 표지자가 질환으로 인한 신경 손상의 진행을 실시간으로 민감하게 평가할 수 없다는 문제가 대두되면서 치료 중 NEDA-3를 만족해도 반드시 장기적으로 좋은 예후를 예측할 수 없다는 것이 보고되었다.9,18,19 치료 반응의 표적으로 생각했던 재발 및 MRI 활성도는 질환의 염증성 병리를 시사하는 표지자이나, 재발과 재발 사이에 만성 염증 및 신경퇴행성 손상에 의해 발생하는 재발과 독립된 진행(progression independent relapse activity, PIRA)이 신경계 손상을 유발하는 또 다른 중요한 기전이며, 이러한 PIRA는 질환의 초기부터 존재할 수 있지만 이를 제대로 모니터할 수 있는 방법이 아직은 제한되어 있기 때문이다.20-22 여기에 최근 처음부터 이러한 고효능 약물로 치료한 환자들이 중등도 효능 약물에서 시작하여 단계적으로 격상한 환자들보다 재발 및 장기적인 장애 진행을 막는 효과가 더 크고 유의한 부작용 위험성도 높지 않아 치료에 따른 위험 대비 이익 비율이 훨씬 높다는 대규모 역학 연구 결과들이 쏟아지면서 많은 전문가들은 고효능 약물들을 질환의 조기에 사용할수록 장기적으로 좋은 결과를 얻을 수 있다고 제시하고 있다.10,23-26
하지만 2022년 4월 기준으로 국내 30개 의료기관의 신경과 전문의를 대상으로 한 다발성경화증 환자 숫자 및 치료 현황 조사에서 1,290명의 다발성경화증 환자 중 93%가 질환 조절 치료를 받고 있었고, 이 중 22%만이 고효능 약물로 치료를 받고 있었다.27 이는 최근까지도 상당수의 국내의 다발성경화증 환자가 최적의 치료를 받고 있지 못할 가능성을 시사한다. 또한 지역 간 치료 실태의 차이로 80%의 다발성경화증 환자가 수도권에서 치료 및 관리하고 있었고, 고효능 약물의 사용 비중도 비수도권 지역에서 20% 미만인 곳들이 확인되었다.27 다발성경화증 치료에 대한 최신 근거 중심의 가이드라인과 실제 국내 치료 현황 사이의 이러한 불일치는 치료 관성(treatment inertia), 즉 질병 활성의 증거가 있음에도 불구하고 치료를 시작하거나 확대하는 것이 지연되는 것에 대한 가능성을 제기한다. 인간은 기본적으로 선택된 것을 그대로 유지하려는 경향이 있으며, 환자와 의사 모두 이러한 편견에서 자유롭지 못할 수 있다.28 일부 신경과 전문의는 최신 다발성경화증 연구 및 치료 가이드라인을 완전히 숙지하지 못할 수 있으며, 고효능 약물의 부작용과 잠재적 위험에 대한 우려로 인해 처방을 꺼릴 수 있다. 또한 질환의 활성도 및 경과는 개개인에 따라 다양한데, 질환에 대한 경험이 적은 신경과 의사는 질병의 진행을 정확하게 평가하기 어려울 수 있고, 재발이 없다는 이유로 MRI상 관찰되는 질환의 활성도를 과소평가할 수 있다. 이 외에도 치료 결정과정에서 환자의 참여 부족 및 치료의 부작용에 대한 과도한 염려도 치료 관성을 유발하는 원인이 될 수 있다. 이러한 치료 관성은 결국 치료 기회의 상실을 초래하여 환자들의 임상 결과의 악화 및 장애의 증가로 이어질 수 있기 때문에 학회 및 의료기관의 국내 신경과 전문의들에 대한 적극적인 교육적 개입이 필요하며,29 질환과 최신 치료에 대한 이해를 높이는 환자들의 교육을 통해 환자들이 자신의 치료 결정과정에 적극적으로 참여할 수 있도록 해야 할 것이다.
본 연구는 단일기관에서 적은 숫자의 환자를 대상으로 조사한 후향적 연구인 한계가 있다. 그럼에도 불구하고 최신 가이드라인을 잘 준수하여 면밀히 모니터하고, 적극적으로 치료하였을 때 국내의 약 절반의 재발 완화 다발성경화증 환자들에서 중등도 효능 약물 치료 수년 이내 고효능 약물이 필요하며, 이는 서구에서 발표되고 있는 최신 치료 결과들과 다르지 않다는 것을 확인하였다는 점에서 큰 의미가 있겠다. 향후 다기관 및 보다 많은 수의 환자들을 대상으로 최근 발병한 국내의 다발성경화증 환자들의 정확한 치료 실태를 파악하고, 국내의 치료 관성 원인의 이해 및 적극적인 치료를 독려하기 위한 연구들이 필요하겠다.
Notes
Conflict of Interest
The author(s) declared the following potential conflicts of interest with respect to the research, authorship, and/ or publication of this article: Park NY, Kim MJ, Kim KH, and Hyun JW reports no disclosures. Kim SH received a grant from the National Research Foundation of Korea and National Cancer Center; consulted and received honoraria from Bayer Schering Pharma, Merck Serono, Eisai, Teva-Handok, Celltrion, and Roche. Kim HJ received a grant from the National Research Foundation of Korea and research support from AprilBio, Eisai and UCB; received consultancy/speaker fees from Alexion, Altos Biologics, AstraZeneca, Biogen, Daewoong Pharmaceutical, Eisai, GC Pharma, Handok Pharmaceutical, Kaigene, Kolon Life Science, MDimune, Merck Serono, Mitsubishi Tanabe Pharma, Roche, and Sanofi Genzyme; is a co-editor for the Multiple Sclerosis Journal and an associated editor for the Journal of Clinical Neurology.