항CD20단일클론항체(anti-CD20 monoclonal antibody)가 다발경화증(multiple sclerosis)의 질병 활성도를 조절하는 근거가 누적되면서 B세포 억제가 다발경화증 치료의 한 축으로 주목을 받고 있다.
1 리툭시맙(rituximab)은 B세포 표면에 존재하는 CD20을 표적으로 하는 키메라항체로서, 오크렐리주맙(ocrelizumab), 오파투무맙(ofatumumab), 우블리투시맙(ublituximab)과 함께 선택적으로 CD20양성 B세포를 소실시키는 약제이다. 호중구 감소증(neutropenia)은 다발경화증의 질병조절 치료(disease modifying therapy) 사용 중에 발생 가능한 부작용이며, 연구에 따라 절대호중구수(absolute neutrophil count, ANC)가 1.0×10
9/L 또는 1.5×10
9/L 이하로 감소되었을 때로 정의한다.
2-5 본 증례에서는 리툭시맙 투여 후 심각한 호중구 감소증이 발생 후 과립구 집락촉진인자(granulocyte colony-stimulating factors, G-CSF)의 투여로 회복된 환자를 보고하고자 한다.
증례
37세 남성이 2006년 발병한 다발경화증으로 치료 및 추적 관찰 관찰 중이었다. 처음 증상으로 좌측 팔다리 감각이상이 발생하였으며, 2007년 다발경화증 진단 하에 질병조절 치료를 시작하였다. 글라티라머 아세테이트(glatiramer acetate)부터 사용하였으나, 2017년까지 6차례 재발이 발생하여 테리플루노마이드(teriflunomide), 인터페론 베타(beta-interferon) 순으로 약제를 변경하였다. 이후에도 반복되는 재발로 2018년에는 알렘투주맙(alemtuzumab) 치료 시도하였으나, 림프구 감소증 및 갑상선 기능 이상이 발생하여 지속적인 투여가 불가하였으며, 2020년 추가 치료를 위해 본원으로 내원하였다.
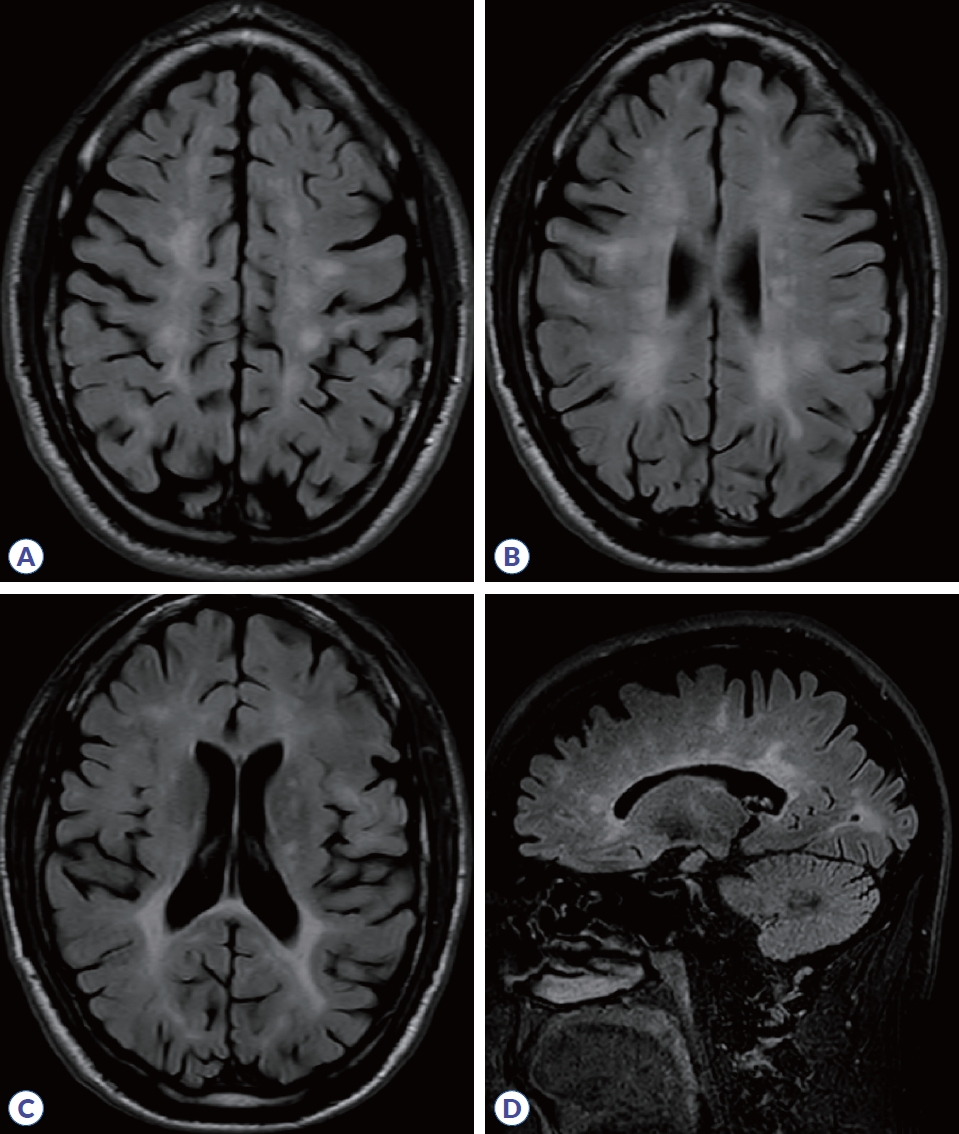
내원 당시 시행한 뇌 및 척수 MRI 검사상 양측 뇌실 주변, 피질곁(juxtacortical), 뇌간, 척수에 다발성 고신호 강도가 관찰되고, 전반적인 뇌 위축과 경미한 뇌실 확장(ventriculomegaly)이 보였다(
Fig. 1). Expanded disability status score (EDSS)는 5.5점으로 현저한 보행 및 구음 장애를 보였으며, 혈청 항아쿠아포린4항체와 항MOG항체는 모두 음성이었다. 항JCV항체(anti-John-Cunningham virus antibody)는 지속적으로 검출되지 않았다. 높은 질병 활성도의 재발 완화 다발성경화증(relapsing-remitting multiple sclerosis)으로 고효능 치료제(high-efficacy therapy) 중 나탈리주맙(natalizumab)을 투여하였으며, 2년 뒤에는 진행다초점백질뇌병증(progressive multifocal leukoencephalopathy) 위험성을 고려해 보호자의 요청에 따라 클라드리빈(cladribine)으로 교체하였다. 클라드리빈 투여 4개월 후 주관적인 보행기능 악화를 호소하여 고용량 스테로이드 치료 후 호전되었으며, 클라드리빈 투여 5개월 후 시행한 뇌, 척수 MRI와 12개월 후 시행한 뇌 MRI상 새로운 병변이나 기존 병변의 확장은 보이지 않았다. 하지만 클라드리빈 투여 6개월 이후로 환자는 점차 보행 악화를 호소하였으며, 2년차 클라드리빈 투여에도 불구하고 6개월 간격으로 시행한 EDSS에서 모두 6.0점으로 기존보다 장애가 악화된 소견을 보였다. 재발 진행형 다발경화증(relapsing progressive MS)으로 판단 하에 클라드리빈 투여 16개월 후, 리툭시맙 투여를 시작하였다.
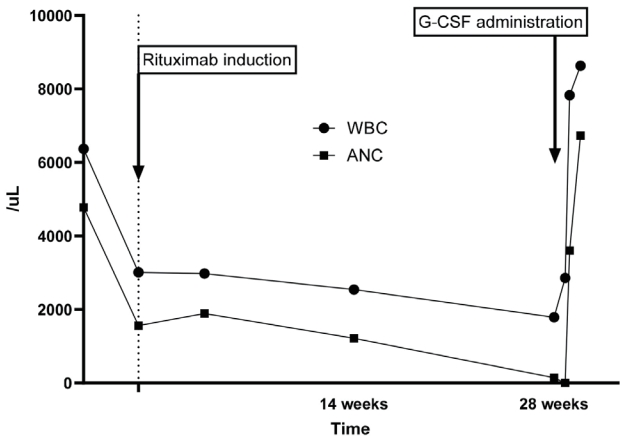
리툭시맙 투약 전 말초혈액검사상 혈색소 16.5 g/dL, 백혈구 수 3,010/mm
3, ANC 1,560/mm
3, 혈소판 수는 169,000/mm
3였다. 리툭시맙 1,000 mg을 2주 간격으로 2회 투여 후 1개월, 3개월에 각각 백혈구 수 2,980/mm
3 (ANC 1,889/mm
3), 2,540/mm
3 ( ANC 1,217/mm
3)였다. 6개월 이후 추적 혈 액검사에서 백혈구 수는 1,790/mm
3, ANC 143/mm
3였으며, 5일 뒤 추적검사에서 호중구는 0%로 일반 혈액검사에서는 호중구가 관찰되지 않는 심한 호중구 감소증이었다. 당시 혈압은 130/64 mmHg, 맥박은 112/minutes, 호흡수 20/minutes, 체온은 36.9℃였으며, 진찰상 감염을 시사하는 소견은 없었으나 환자는 가벼운 열감을 호소했다. 이후 호중구 회복을 위해 과립구 집락촉진인자(G-CSF, filgrastim)를 ANC 1,500/mm
3 이상으로 회복될 때까지 2일 동안 300 mcg 및 150 mcg씩 각각 피하 주사하였다. 투여 다음 날부터 현저히 호중구 수가 호전되었으며, filgrastim 투여 2일째 백혈구 수 7,830/mm
3, ANC 3,602/mm
3로 수치가 정상으로 회복되었다(
Fig. 2). 또한, 회복 과정에서 임상적 재발은 없었다. 본 환자는 리툭시맙 투여로 심각한 호중구 감소증이 발생했다고 판단하여 질병조절 치료의 변경을 계획 중이다.
고찰
호중구 감소증은 B세포 감소 기전을 가지는 항CD20약제 투여의 드문 부작용으로 발생하며, 마지막 리툭시맙 투여 4주 이후에 발생하는 경우를 후기발병 호중구 감소증(late-onset neutropenia)으로 정의한다.
2 림프종 환자를 대상으로 한 연구에서 리툭시맙 투여 후 6-27%의 환자에서 후기발병 호중구 감소증이 발생하는 것으로 보고되었으며,
3 다발경화증 환자에서는 1.2-4.4%로 상대적으로 낮게 보고되어 있다.
6-8 현재까지 리툭시맙 투여로 발생하는 호중구 감소증의 기전은 정확히 알려져 있지 않으나, 과립구의 성숙 정지(maturation arrest), 항체 매개 호중구 파괴, 면역글로불린 G (immunoglobulin G) Fc 수용체(Fc receptor)의 특이 다형성(polymorphism), 조혈성장인자의 변화 등 다양한 가능성들이 언급되고 있다.
3,4,9
최근 항CD20 치료 중 호중구 감소증이 발생한 다발경화증 환자 연구에 따르면, 마지막 투여로부터 3개월이 지난 시점에 가장 많이 발생하였고, Nadir 시 ANC의 중간값은 400/mm
3였다.
10 이 중 58%의 환자(11/19)가 G-CSF 투여 후 호중구 감소증이 회복되었으며, 우려와는 달리 G-CSF 투여 후 임상적 재발이 보고된 사례는 없었다. 본 증례의 환자도 호중구가 0/mm
3까지 심하게 감소하였으나, G-CSF 2일간 투여 후 잘 회복되었으며 G-CSF 투여 중에 재발을 포함한 특이 부작용을 보이지 않았다. 만약 발열 등 감염 징후가 보였다면 선제적 항생제 사용이 필요하나, 본 환자는 감염 징후가 없었고 활력 징후가 안정적으로 항생제 사용은 하지 않았다. 또한, 호중구 감소증 발생 이후에 항CD20 치료의 지속 여부에 대해서는 정립된 사항은 없으나 앞선 연구들에서 항CD20항체 약물의 투여를 지속한 11명 중 2명의 환자에서 호중구 감소증이 다시 발생하였으며, 이 중 1명의 환자는 리툭시맙에서 오크렐리주맙으로 변경한 경우였다.
5,10 따라서 항CD20 치료 중 호중구 감소증이 발생한 경우 다른 기전의 질병 조절 치료로의 변경 고려가 필요하며, 키메릭항체에서 인체화(humanized)된 단일클론항체 약물로 교체하는 방법은 호중구 감소증 발생을 방지하는 데 유용할 것으로 생각되지는 않는다. 본 환자에서도 향후 항CD20 약제가 아닌 다른 기전의 질병 조절 치료로 변경을 예정하고 있다.
내과적 자가면역질환을 대상으로 한 연구에서, 리툭시맙 투여 후 호중구 감소증 발생의 위험인자로 전신홍반루푸스(systemtic lupus erythematosus)와 cyclophosphamide 병합 치료가 보고된 바가 있다.
11 따라서 본 환자와 같이 여러 기전의 면역 치료를 시행한 경우, 호중구 감소증 발생에 더 유의할 필요가 있다. 호중구 감소증의 발생은 중증 감염의 위험과 연관이 있으므로,
12 향후 다발경화증을 포함한 중추신경계 탈수초성질환에서 리툭시맙 투여 후 호중구 감소증 발생의 위험요인에 대해서 체계적인 연구가 요구된다.
저자들은 리툭시맙 투여 중 발생한 심한 호중구 감소증이 발생한 환자가 G-CSF 투여 후 효과적으로 회복한 증례를 경험하여 보고한다. 본 증례와 같이 리툭시맙 투여 1개월 이후에도 후기발병 호중구 감소증이 발생할 수 있으므로 적절한 처치를 위해 정기적인 혈액검사를 제안한다.




 PDF Links
PDF Links PubReader
PubReader ePub Link
ePub Link Full text via DOI
Full text via DOI Download Citation
Download Citation Print
Print