| J Mult Scler Neuroimmunol > Volume 15(1); 2024 > Article |
|
ABSTRACT
Inflammatory diseases of the central nervous system (CNS) include multiple sclerosis (MS), neuromyelitis optica spectrum disorder (NMOSD), myelin oligodendrocyte glycoprotein antibody-associated disease (MOGAD), and acute disseminated encephalomyelitis. In addition, various rheumatoid autoimmune diseases, autoimmune encephalitis, and medications such as immune checkpoint inhibitors can cause inflammation in the CNS. Radiological findings are very useful for us in differentiating inflammatory diseases of the CNS. On MRI, the shape, location, length/size, and gadolinium enhancement pattern of the lesions as well as the recovery and atrophy of the lesions following the acute phase, serve as important biomarkers for differentiating the diseases. In this review, we will highlight the typical characteristics MRI of optic neuritis, brain lesions, and myelitis in MS, NMOSD, and MOGAD, and outline the features of other inflammatory diseases of CNS.
중추신경계 염증성 질환에는 대표적으로 다발경화증, 시신경척수염, 항수초희소돌기아교세포당단백질항체 관련 질환(myelin oligodendrocyte glycoprotein antibody-associated disease, MOGAD)과 소아에서 흔한 급성파종성뇌척수염(acute disseminated encephalomyelitis, ADEM)이 있으며, 그 외에도 전신홍반루푸스이나 쇼그렌증후군, 베체트병, 사르코이드증 등도 중추신경계를 침범할 수 있다.1 그 외에도 자가면역 뇌염이나 일부 감염성 질환이나 대사성 질환에 의해서도 중추신경계 염증성 질환을 유발될 수 있으며, 최근에는 면역관문 억제제(immune checkpoint inhibitors)에 의한 보고도 있다.2 임상 양상과 병력, 신경학적 진찰은 진단에 매우 중요하나 때로는 제한적일 수 있어서, 각 질환별 영상학적 특징과 차이를 아는 것이 중추신경계 염증성 질환들의 감별 진단에 필요하겠다. 이 논문에서는 다발경화증, 시신경척수염와 MOGAD에서 발생하는 시신경염, 뇌병변 및 척수염의 자기공명영상(MRI)의 특징을 중점으로 살펴보고, 다양한 중추신경계 염증성 질환의 특징적인 소견들을 간략히 소개하고자 한다.
시신경염은 다발경화증에서 초기 증상으로 25%, 전체 질병 경과의 70%까지 차지하고 시신경척수염과 MOGAD에서도 흔하게 발생하며, 시력 저하와 색각 감소, 시야장애의 증상을 동반한다.3 다발경화증에서 발생하는 시신경염의 전형적인 영상학적 소견은 병변이 주로 편측으로 발생하고, 대부분 canalicular segment에 위치하며, 병변의 길이가 전체 시신경의 1/2 미만으로 짧다(Fig. 1, Table 1). 스웨덴 연구에서 472명의 다발경화증 환자들을 보고한 바에 따르면 약 21%에서 첫 증상으로 시신경염이 발생하였고, 전체 경과 중에 양안 모두 시신경염이 발생한 경우는 약 5.5%였으나 동시에 양측 시신경염이 발생하는 경우는 0.42%로 매우 드물게 보고되었다. 이에 반해 시신경척수염과 MOGAD에서는 약 30-35%에서 동시에 양측 시신경염이 발생하는 것으로 나타났으며, 병변의 길이도 전체 시신경의 1/2보다 긴 병변을 가지는 경우가 많다(Figs. 2, 3). 안구 MRI에서 시신경 척수염이나 MOGAD의 시신경염 병변 길이는 다발경화증에 비해 약 2-3배의 길었다.4,5 시신경염의 호발 부위도 질병 간 차이를 보이는데, 시신경교차(optic chiasm)를 침범하는 경우가 다발경화증이나 MOGAD에서는 2-15%였으나 시신경척수염의 경우 약 64%로 매우 높게 나타났다. MOGAD에서는 상대적으로 시신경 앞쪽분절을 침범하는 경우가 많았으며, 시신경 유두 부종도 많게는 약 50%에서 보고되었다. 또한 조영증강 영상에서 신경주위 조영증강(perineural enhancement)이 관찰될 수 있다(Fig. 3, Table 1).
자기공명영상의 특수기법으로 얻은 자기화전달비율(magnetization transfer ratio, MTR)도 질환들의 감별에 도움이 되는 데, 이는 자기화전달파에 대해, 자유로이 움직이는 물분자와 수초(myelin) 혹은 축삭막(axon membrane)에 붙어 있는 상태의 물분자가 다른 특성을 보이는 것을 이용하여 계산한 것이다. 뇌척수액에서는 MTR이 0에 수렴하며, 정상 뇌조직에서는 약 40-50을 보이는데, 신경 손상이 발생하면 MTR이 감소한다.6 다발경화증에서 시신경염이 발생한 경우 병변 부위의 MTR이 증상 발생 8개월 뒤 가장 낮고(nadir) 이후 서서히 호전되는 추이를 보인다.7 다발경화증에 비해 시신경척수염이나 MOGAD에서는 MTR의 감소가 더 심한 것으로 나타났다.8
안구빛간섭단층촬영(optical coherence tomography, OCT)은 망막 시신경층의 두께를 평가하는 데 이용할 수 있으며, 신경절세포(ganglion cell)의 축삭이 모이는 시신경유두의 망막신경섬유층(retinal nerve fiber layer, RNFL)과 황반 신경절세포-내망상층(ganglion cell-inner plexiform layer, GCIP)의 두께를 주로 측정한다.9 시신경염 급성기에는 망막 부종으로 인해 OCT에서 시신경층이 두꺼워진 것이 관찰된다. 시신경염이 발생한 MOGAD의 31개와 다발경화증의 48개 눈들을 정상측 눈에 비교하였을 때, GCIP 두께는 차이가 없었으나 RNFL의 두께는 유의하게 두꺼워져 있으며, 특히 MOGAD에서는 RNFL의 중앙값이 45 μm (interquartile rage [IQR], 17-105)로 다발경화증(중앙값, 7.5; IQR, 1-18)에 비해 약 6배 높았다.10 빛간섭단층혈관조영술(OCT angiography)에서는 다발경화증이나 시신경 척수염에서 병변측 눈이 정상측 눈에 비해 유두주변모세혈관총(peripapillary capillary plexus)의 밀도가 감소하였으며, 이는 시신경척수염에서 더욱 뚜렷하였다.11
다발경화증은 2017 McDonald 진단 기준에서 뇌병변은 진단에 필수적이며, 피질/피질곁(cortical/juxtacortical), 뇌실주위(periventricular), 천막밑(infratentorial)에 탈수초 병변이 확인되는 경우로 제시되었다(Fig. 4, Table 2).12 전형적인 병변의 경우, 경계가 명확한 타원 혹은 원형 모양이며, 조영증강 영상에서 균질하게 조영증강되거나 고리(ring) 혹은 열린고리(open-ring)로 나타난다.13,14 가쪽뇌실 주위에 병변이 발생하면 손가락의 모양과 유사하여 Dawson’s finger라고도 한다. 병변이 발생했던 부위에는 시간이 지나면 조직 소실(tissue loss)로 인해 T1 강조영상에서 검게 보이는 검은구멍(T1-black hole)이 관찰될 수 있다(Fig. 4D). 또한, 아래측두엽 뇌실 주변에 병변이 생기는 경우 다발경화증의 가능성을 좀 더 시사한다(Fig. 4B).
다발경화증과 달리 시신경척수염이나 MOGAD에서는 진단에 뇌병변이 필수적이지는 않으며, 뇌병변의 유무는 진단 시 각각 23-30%와 27-44%로 보고되었다.8,15 시신경척수염에서 뇌병변은 주로 뇌실 주변을 따라 발생하는데, 제3뇌실과 대뇌수도, 시상, 시상하부, 제4뇌실 주변의 뇌간에 호발하며, 맨아래구역(area postrema)을 포함한 등쪽숨뇌(dorsal medulla)에 생긴 병변은 경수까지 이어지기도 한다(Fig. 5).16 가측뇌실 주변 뇌량 병변(callosal lesion)은 뇌실막내층(ependymal lining)을 따라 발생하여 ‘marble’ 혹은 ‘arch bridge pattern’이라 한다. 병변의 모양은 다발경화증과 달리 잘 정형화되지 않으며, 혈관성 부종(vasogenic edema)을 동반하거나 종괴양(tumefactive) 모습으로 보일 수 있고, 만성화된 경우 낭종유사 공동 변화(cystic-like cavity change)가 동반될 수 있다. 또한, 편측 혹은 양측 피질척수로를 따라 병변이 생기는 경우 시신경척수염의 가능성을 시사한다. 조영증강은 cloud-like 혹은 linear한 양상이며, 뇌수막 조영증강도 동반될 수 있다(Table 2). MOGAD에서 뇌병변은 ADEM과 유사하게 나타나며, 백질, 깊은회색질, 소뇌중간다리, 뇌간, 피질에 병변의 경계가 불명확하고 융합성(confluent) 병변이 관찰된다(Fig. 6).17 조영증강은 동반되지 않기도 하고, 편측 혹은 양측 피질 연수막 조영증강을 나타나기도 한다.
이러한 병변의 위치나 모양은 질병들을 서로 구분하는 데 매우 중요한 기준이 된다(Table 2). 아래측두엽 뇌실 주위 병변과 U섬유 병변, Dawson’s finger 모두 동반하는 경우에는 시신경 척수염과 MOGAD에 비해 다발경화증에 대한 양성예측률이 각각 90.3%와 97.6%로 매우 높게 나타났다.18 피질 병변의 유무도 다발경화증과 다른 중추신경계 염증성 질환들을 구분하는 데 도움이 된다. 피질 병변은 형태에 따라 4가지로 구분되는데 (1형: mixed white and gray matter lesion, 2형: intracortical lesion, 3형: subpial lesion, 4형: ‘worm-like lesion),19 하나 이상의 피질 병변만 있더라도 다발경화증과 단독임상증후군에 대해 민감도 59.0%, 특이도 93.6%와 정확성 73.9%를 보였다.20 다발경화증을 시사하는 또 다른 영상 소견인 중심정맥신호(central vein sign, CVS)는 3 mm 이상 크기의 탈수초 병변 중심부를 관통하는 직경 2 mm 미만의 혈관을 의미한다. CVS가 뇌병변의 40%에 존재하는 것을 기준(cut-off)으로 하였을 경우, 다발경화증 진단에 민감도 78.7%, 특이도 86.0%, 정확성 81.5%를 보였다. 또한, 상자성 테두리 병변(paramagnetic rim lesion)은 다발경화증에서 병변 주변 만성염증(perilesional chronic inflammation)을 반영하는 것으로, 병리적으로는 병변 가장자리에 철함유 미세아교세포/대식세포(iron-laden microglial/macrophage)가 관찰되며, T2* 강조영상에서 해당 부분이 저강도 신호로 나타난다.21 다른 중추신경계 염증성 질환이나 비염증성 질환에서는 paramagnetic rim lesion이 하나 이상 존재하는 경우는 10% 미만이나 다발경화증에서는 약 52-58%로 흔하게 나타났고, CVS (cut-off value 40%)와 같이 이용 시, 다발경화증에 대한 특이도가 99%였다.
뇌줄기에서 시신경척수염과 MOGAD는 호발하는 병변의 위치에 차이를 보인다. 중뇌에서는 두 질환 모두 대뇌다리(cerebral peduncle)를 침범하나 시신경척수염에 비해 MOGAD에서 교뇌의 소뇌다리(cerebellar peduncle)의 침범이 흔했고(오즈비, 5.22; 95% 신뢰구간, 1.65-16.52), 등쪽연수 침범이 더 적었다(오즈비, 0.20; 95% 신뢰구간, 0.09-0.43).22
급성기 이후 병변 크기 변화도 질병을 구분할 수 있는 특징이다. 특히, MOGAD는 다발경화증이나 시신경척수염에 비해 급성기에 발생하는 뇌병변의 면적은 상대적으로 크나 급성기가 지난 후 병변 크기의 감소가 더욱 뚜렷하고, 완전 소실(complete resolution)되는 경우도 다발경화증과 시신경척수염에서는 각각 17%와 10%인데 반해 MOGAD에서는 40%까지 보고되었다.23
척수염에 대한 원인을 감별하기 위해서 병변의 길이가 척추 분절 3개 이상을 침범하는 종단 방향으로 광범위하게 침범하는 횡단척수염(longitudinally extensive transverse myelitis, LETM)인지 확인하는 것이 필요하다. 다발경화증에서 발생하는 척수염은 대부분 짧은 병변이며, 주로 경수나 흉수에 흔하고, 여러 개의 병변들이 존재한다(Table 3).24 또한 척수단면에서 병변은 한쪽으로 치우쳐져(eccentric or wedge shape) 있는 불완전 횡단척수염(incomplete transvers myelitis)으로 나타난다(Fig. 7). 조영증강은 균질하게 나타나거나 고리 양상을 보인다. 시신경척수염은 약 85%에서 LETM으로 나타나며, 단상성 LETM의 50%, 재발성 LETM의 93% 원인을 차지한다. 경수나 흉수에 호발하고, 앞서 언급한 것처럼 연수까지 병변이 이어질 수 있으며, 완전 횡단척수염의 양상으로 보이는 경우가 많다. 횡단면 영상에서 척수의 중심관 주변으로 중앙부에 병변이 위치하며, 척수 부종도 동반하며, 고리 혹은 반점형(patchy) 조영증강 소견을 주로 보인다(Fig. 8). 시신경척수염에 의한 척수염 중 약 27-54%에서 bright/brighter spotty lesion이 관찰되는데, 횡단 T2 강조영상에서 척수액과 비슷하거나 더 강한 신호를 보이고, T1 강조영상에서 척수액보다 고강도 신호를 보이는 소견을 의미한다.25,26 임상적으로 가지는 의미는 아직 불명확하나 대부분 2개월 지나면 소실되며, MOGAD나 다발경화증, 다른 원인의 척수염에서 약 3-6%로 낮게 보고되어 시신경척수염을 좀 더 시사하는 소견이라 할 수 있다. MOGAD는 LETM의 40-80% 원인으로 보고되며, 비-LETM의 원인에서 44%를 차지한다.27,28 병변이 단면적의 50% 이상을 침범하는 경우가 많고 시상 T2 강조영상에서 T2 hyperintense line로 보이는 경우에는 ‘pseudodilatation of the central canal’이라 언급하기도 한다. 또한, 다발경화증이나 시신경척수염에 비해 척수원뿔(conus medullaris)을 침범하는 빈도(21-41%)가 높다. 급성기에는 대부분 척수 부종이 동반되며 조영증강은 반점형 혹은 경계가 불명확한 비균질형 조영증강을 보이나 빠르게 소실되거나 조영증강이 안 되는 경우도 있다. 횡단면 T2 강조 영상에서 회색질을 침범하여 나타나는 H-sign이 29-50%에서 보고되며, 이는 다발경화증이나 시신경척수염에서는 0-8%로 낮게 보고되어 MOGAD를 더 시사하는 소견이 될 수 있다. 뇌병변과 마찬가지로 병변의 완전 소실이 62-79%로 높으며 병변 부위의 척수 위축은 3-10%로 드물게 발생한다.23,29
ADEM은 주로 소아에서 흔히 발생하며, 약 3/4에서 선행 바이러스 감염을 동반한다.2 대부분 임상적으로 단상성 경과를 보이나 일부에서는 재발하는 경과도 보고된다. 병변은 시신경, 뇌, 척수 모두 발생이 가능하며, 뇌 자기공명영상에서는 1 cm 이상, 미만성의 경계가 불분명한(‘fluffy’) 병변들이 주로 백질을 침범하는 양상이고, 시상 등 깊은 회색질 병변도 동반될 수 있다.
그 외 다양한 염증질환별로 뇌실질에서 호발하는 병변 위치가 알려져 있다. 변역계에 병변이 발생하는 경우 자가면역뇌염이나 하시모토뇌병증에 대한 고려가 필요하고 헤르페스뇌염과 감별을 해야 한다. 면역관문 억제제를 투여받는 환자에서는 다발성 피질하 병변이 발생할 수 있다. 깊은 회색질을 침범할 수 있는 질환 중 항CRMP5/CV2뇌염이나 항DR2뇌염은 줄무늬체를 잘 침범하고, 항Ma2연관 뇌염의 74%에서는 사이뇌 침범이 나타난다. 베체트병이나 사르코이드증, chronic lymphocytic inflammation with pontine perivascular enhancement responsive to steroids는 능형뇌염(rhombencephalitis)을 잘 일으키는 것으로 알려져 있다.30 신경교섬유질 산성 단백질 수막뇌염(glial fibrillary acidic protein meningoencephalitis, GFAP meningoencephalitis)은 뇌실 주변으로 방사선형(radial linear) 조영증강을 보이는 것이 특징적이다.31 일부 중추신경계 염증성 질환에서는 뇌수막 조영증강이 드물지 않게 동반된다고 알려져 있다.2 사르코이드증의 약 49%에서 연수막, 32%에서 경수막 조영증강을 보이는데, 뇌수막 전체에 걸쳐서 조영증강이 나타나거나 결절성 모양을 보일 수 있고, 병변 위치에 따라 폐쇄성 수두증이 동반되기도 한다. 류마티스관절염나 육아종증 다발혈관염이 중추신경계를 침범하는 경우도 뇌수막 조영증강이 나타날 수 있으며, 면역글로불린 G4 관련 질환은 경수막염이 가장 흔한 중추신경계 침범 양상으로 뇌하수체염이나 해면정맥동 이상 소견을 보일 수도 있다.
영상학적 소견은 중추신경계 염증성 질환들을 감별하는 데 중요한 단서를 제시한다. 각 질환에 따른 전형적인 영상학적 소견을 숙지하는 것이 필요하며, 병변의 모양과 위치, 길이, 조영증강 패턴과 급성기가 지난 후 병변의 회복 및 위축 등을 주의 깊게 살펴보아야 한다. 또한, 고식적 자기공명영상 이외에도 OCT나 특수기법으로 촬영한 영상을 이용하여 감별에 필요한 정보를 얻을 수 있다. 다발경화증, 시신경척수염, MOGAD 외에도 자가면역뇌염이나 류마티스질환 등 다양한 질환들이 중추신경계 염증성 질환을 유발시킬 수 있으므로 항상 감별 진단으로 염두에 두는 것이 필요하겠다.
Figure 1.
Orbit MRI in multiple sclerosis. (A) High signal intensity in intraorbital segment of optic nerve (white arrow) is observed in fluid-attenuated inversion recovery image. Left optic nerve is swollen more than the right side. (B) Homogenous enhancement in same area (white arrow) is shown in T1-gadolinium enhancement.
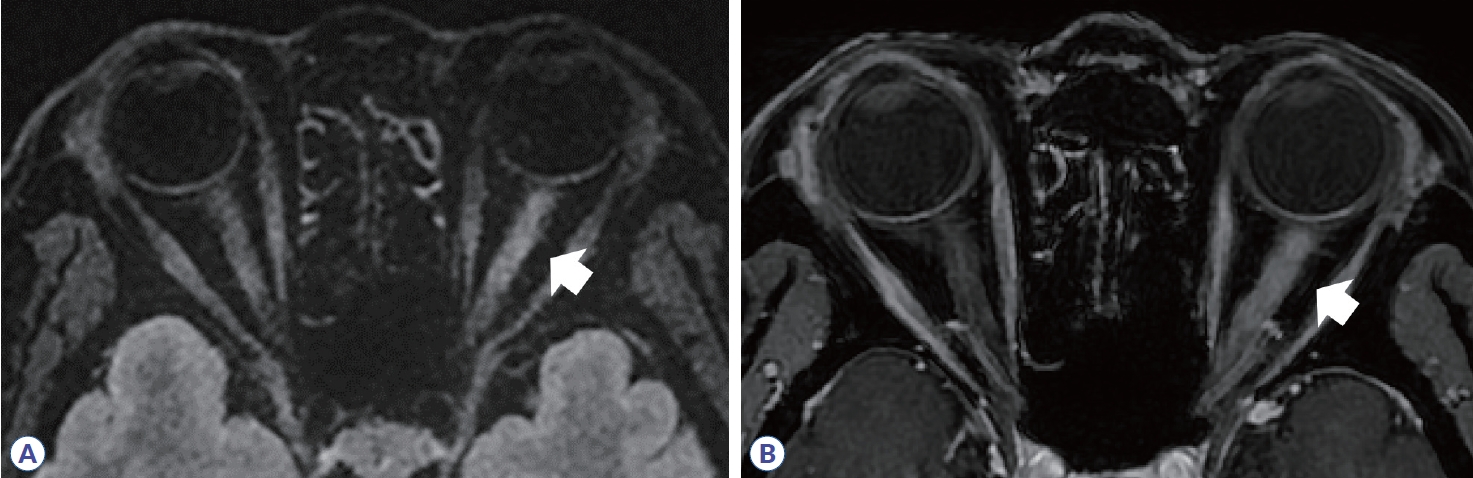
Figure 2.
Orbit MRI in neuromyelitis optica spectrum disorder. (A, B) High signal intensity is observed along the right optic nerve, optic chiasm, and optic tract (arrow). (C) Gadolinium enhancement and edema are observed along the optic nerve lesion (arrow). (D) Follow-up orbit MRI reveals atrophic change in right optic nerve and chiasm (arrowheads).
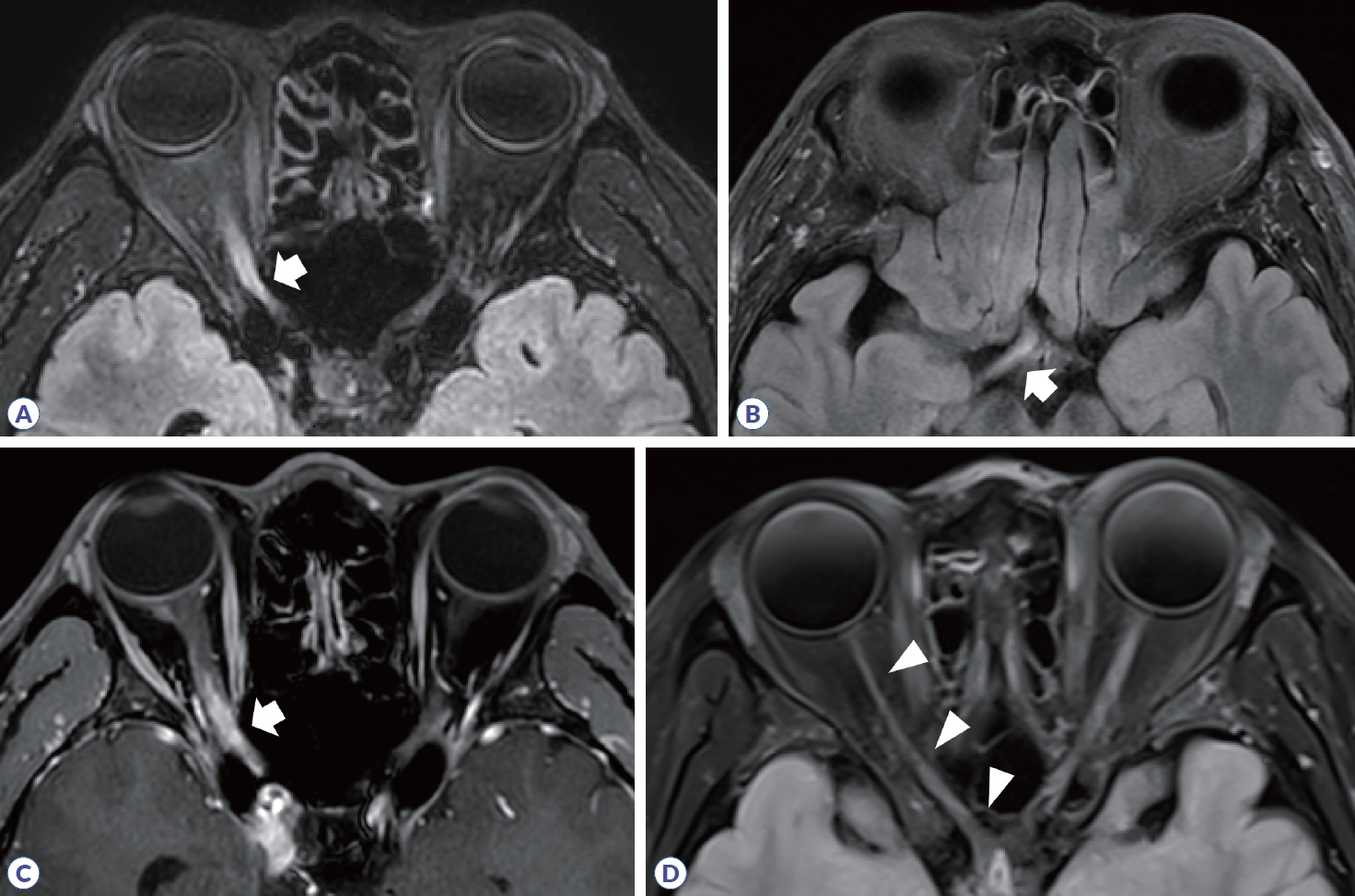
Figure 3.
Orbit MRI in myelin oligodendrocyte glycoprotein antibody-associated disease. (A, B) High signal intensity and gadolinium enhancement are observed in right optic nerve (arrow). (C) In coronary view of T1-gadolinium, perineural enhancement is shown (arrowhead).
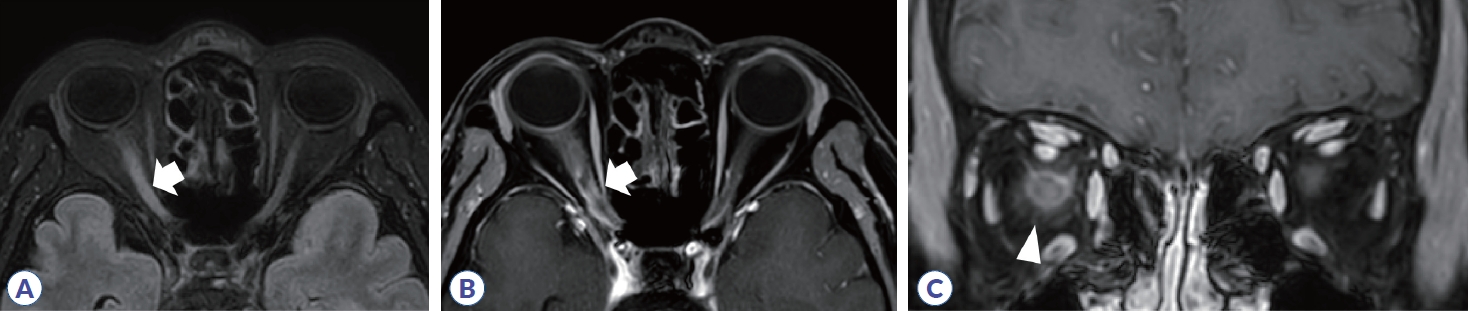
Figure 4.
Brain MRI in multiple sclerosis. (A) Multifocal demyelinating lesions are observed in juxtacortex of right frontal lobe (arrow) and periventricular area (arrowheads). (B) Periventricular lesion in left inferior temporal lobe (arrow). (C) Infratentorial lesion (arrowhead). (D) In chronic phase, T1-black hole due to tissue loss is observed in left frontal lobe (arrow).
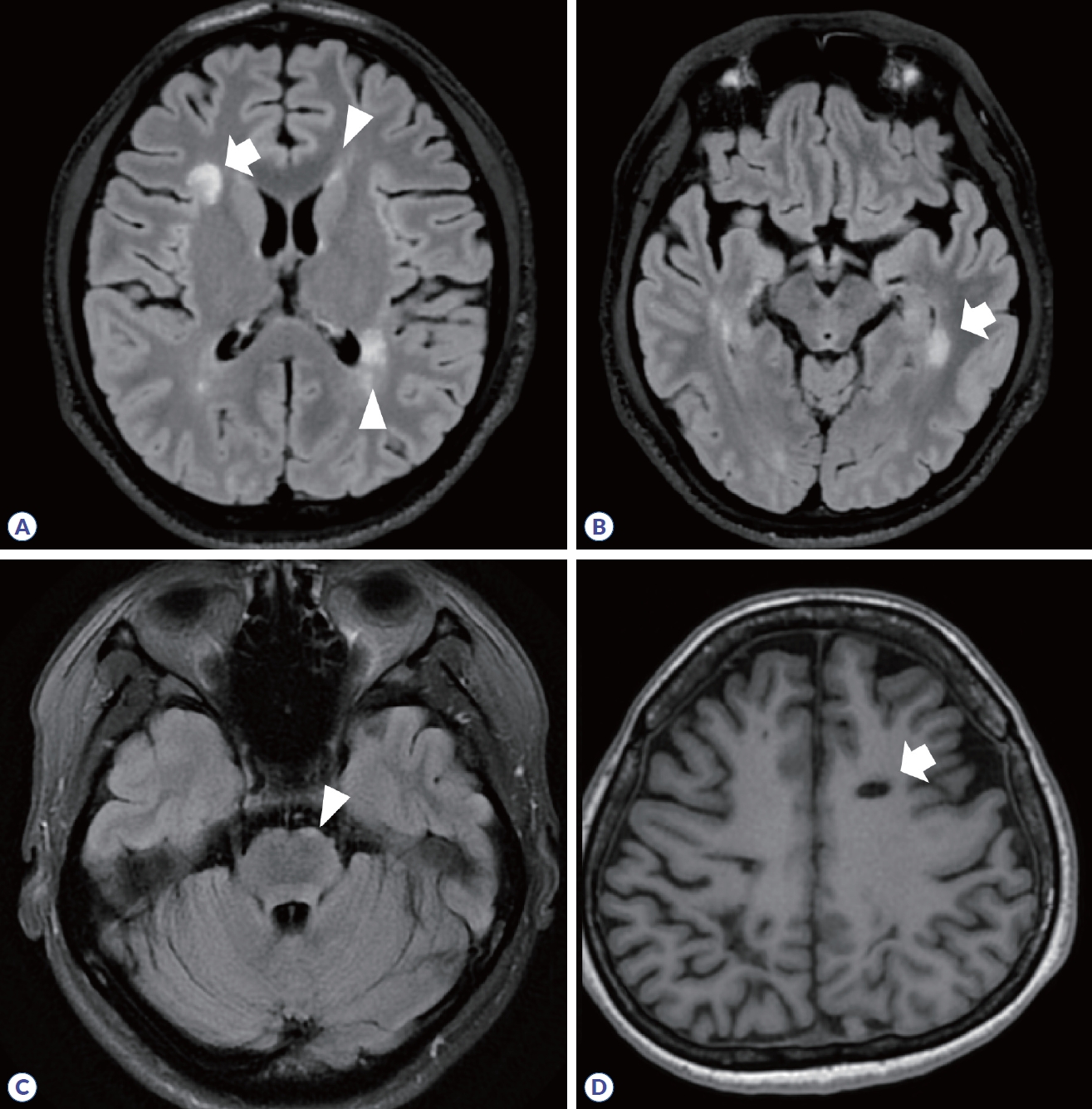
Figure 5.
Brain MRI in neuromyelitis optica spectrum disorder. High signal intensities in fluid-attenuated inversion recovery are observed in dorsal medulla (A, arrow) and right cerebellum (B, arrowhead).
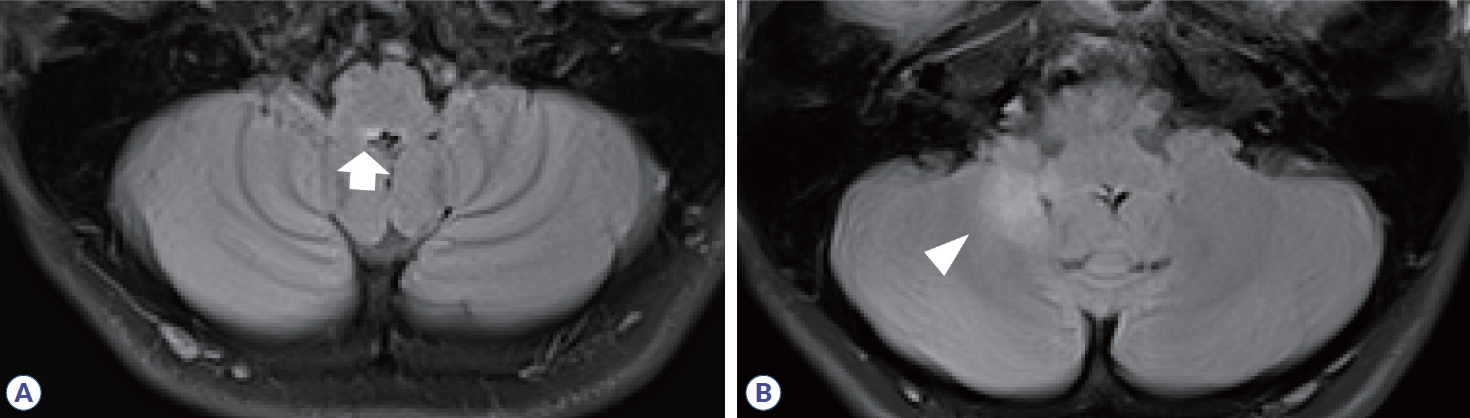
Figure 6.
Brain MRI in myelin oligodendrocyte glycoprotein antibody-associated disease. (A, B) Multifocal, confluent ‘fluffy’ lesions (arrows) are observed in frontal, parietal, and temporal subcortical white matter. (C, D) Nodular enhancing lesions in left temporal lobe, and fuzzy linear and nodular enhancing lesion in right frontal white matter are observed (arrowhead).
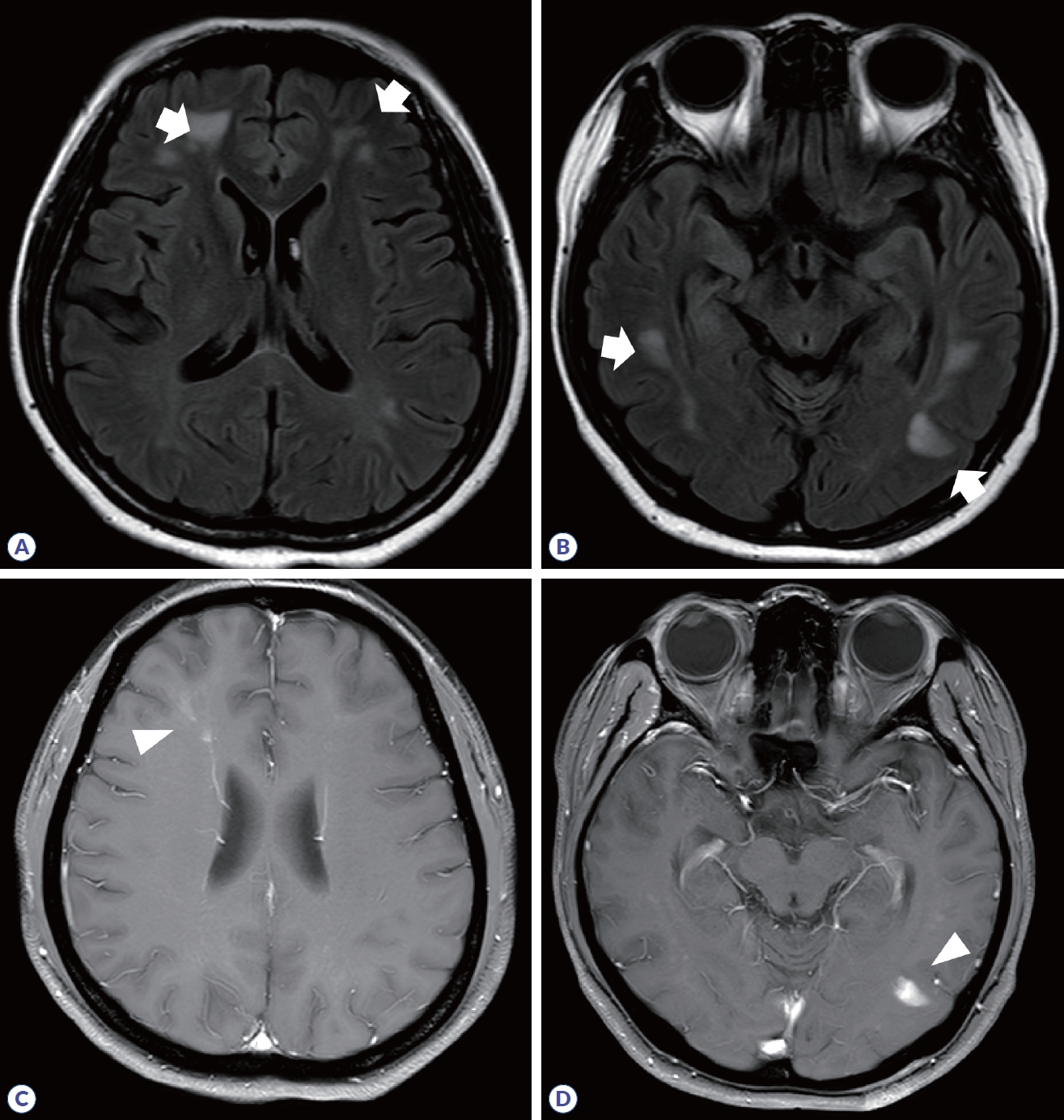
Figure 7.
Spine MRI in multiple sclerosis. (A) High signal intensity is observed in C3 segment in sagittal T2 weighted image (arrow). (B) Axial T2 weighted image show that the lesion is located in the right peripheral area. (C) Homogenous enhancement is shown in T1 gadolinium enhancement.
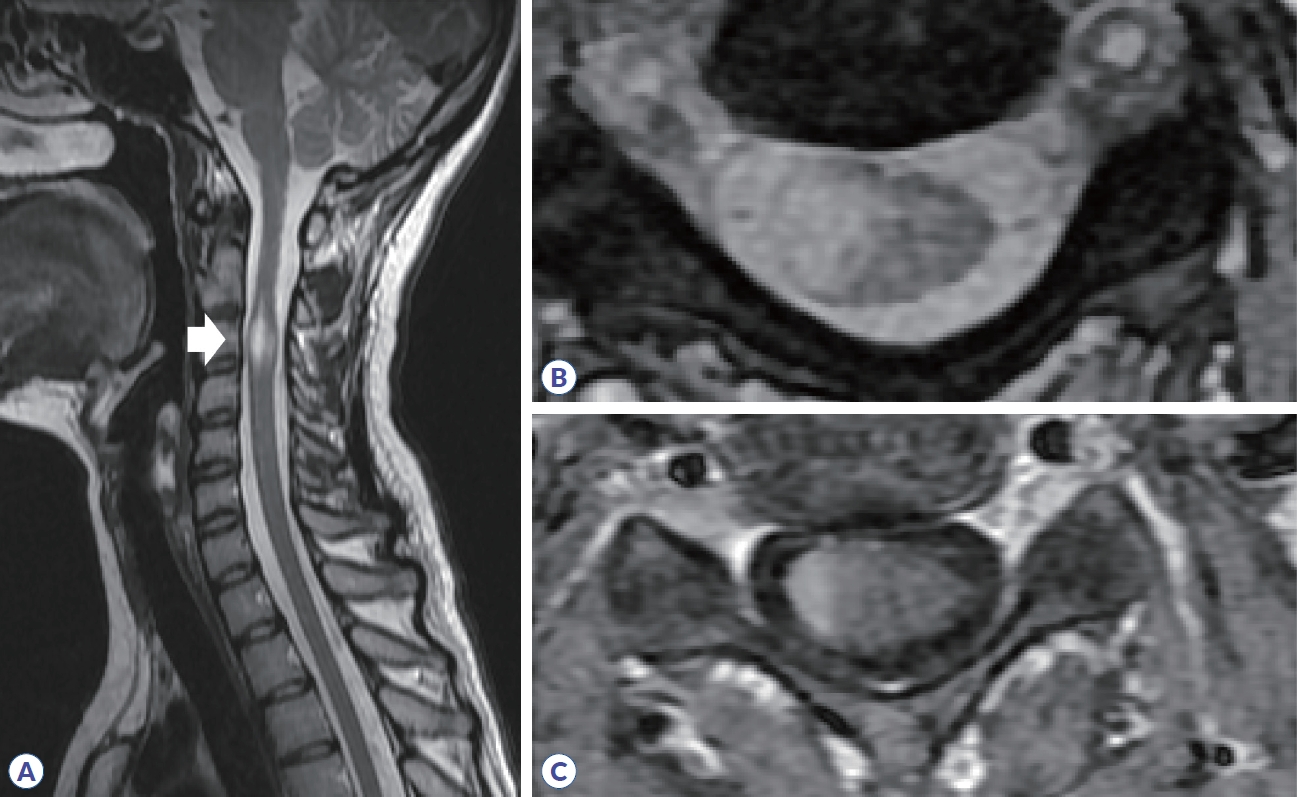
Figure 8.
Spine MRI in neuromyelitis optica spectrum disorder. (A) Longitudinally extensive transverse myelitis (from C7 segment to T7 segment, arrows) is observed in sagittal T2 weighted image. (B) Axial image shows that the lesion is centered in the spinal cord and occupies most of the cross-section area.
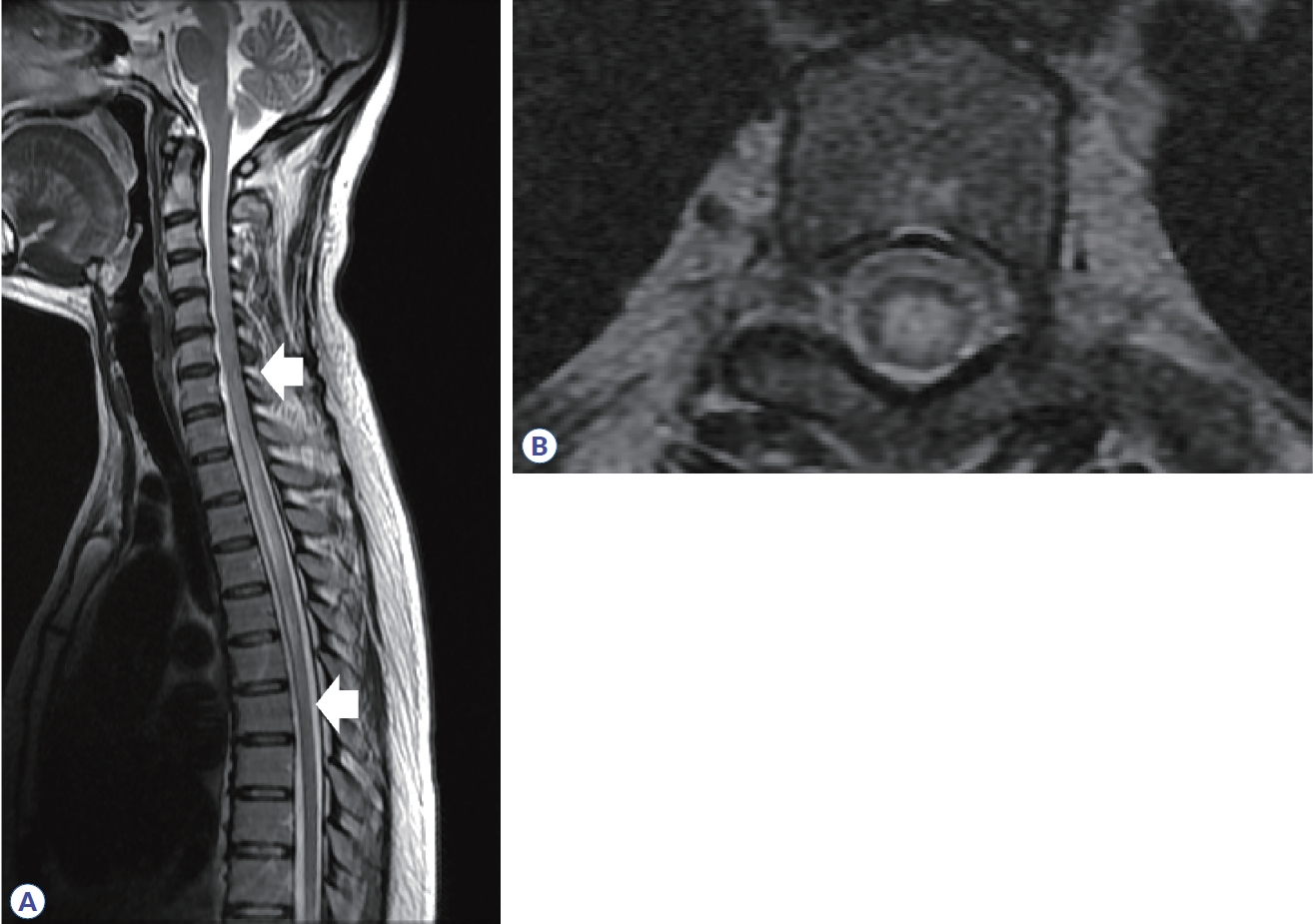
Table 1.
Characteristics of magnetic resonance imaging in optic neuritis among MS, NMOSD, and MOGAD
Table 2.
Characteristics of magnetic resonance imaging in brain lesion among MS, NMOSD, and MOGAD
Table 3.
Characteristics of magnetic resonance imaging in myelitis among MS, NMOSD, and MOGAD
REFERENCES
1. Van Mater H. Pediatric inflammatory brain diseases: a diagnostic approach. Curr Opin Rheumatol 2014;26:553-561.

2. Tillema JM. Imaging of central nervous system demyelinating disorders. Continuum (Minneap Minn) 2023;29:292-323.


4. Akaishi T, Nakashima I, Takeshita T, Kaneko K, Mugikura S, Sato DK, et al. Different etiologies and prognoses of optic neuritis in demyelinating diseases. J Neuroimmunol 2016;299:152-157.


5. Ramanathan S, Prelog K, Barnes EH, Tantsis EM, Reddel SW, Henderson AP, et al. Radiological differentiation of optic neuritis with myelin oligodendrocyte glycoprotein antibodies, aquaporin-4 antibodies, and multiple sclerosis. Mult Scler 2016;22:470-482.



6. Filippi M, Rocca MA. Magnetization transfer magnetic resonance imaging of the brain, spinal cord, and optic nerve. Neurotherapeutics 2007;4:401-413.



7. Hickman SJ, Toosy AT, Jones SJ, Altmann DR, Miszkiel KA, MacManus DG, et al. Serial magnetization transfer imaging in acute optic neuritis. Brain 2004;127:692-700.


8. Cortese R, Prados Carrasco F, Tur C, Bianchi A, Brownlee W, De Angelis F, et al. Differentiating multiple sclerosis from AQP4-neuromyelitis optica spectrum disorder and MOG-antibody disease with imaging. Neurology 2023;100:e308-e323.



9. Petzold A, de Boer JF, Schippling S, Vermersch P, Kardon R, Green A, et al. Optical coherence tomography in multiple sclerosis: a systematic review and meta-analysis. Lancet Neurol 2010;9:921-932.


10. Chen JJ, Sotirchos ES, Henderson AD, Vasileiou ES, Flanagan EP, Bhatti MT, et al. OCT retinal nerve fiber layer thickness differentiates acute optic neuritis from MOG antibody-associated disease and multiple sclerosis: RNFL thickening in acute optic neuritis from MOGAD vs MS. Mult Scler Relat Disord 2022;58:103525.


11. Rogaczewska M, Michalak S, Stopa M. Differentiation between multiple sclerosis and neuromyelitis optica spectrum disorder using optical coherence tomography angiography. Sci Rep 2021;11:10697.




12. Thompson AJ, Banwell BL, Barkhof F, Carroll WM, Coetzee T, Comi G, et al. Diagnosis of multiple sclerosis: 2017 revisions of the McDonald criteria. Lancet Neurol 2018;17:162-173.

13. Hemond CC, Bakshi R. Magnetic resonance imaging in multiple sclerosis. Cold Spring Harb Perspect Med 2018;8:a028969.



14. Sechi E, Cacciaguerra L, Chen JJ, Mariotto S, Fadda G, Dinoto A, et al. Myelin oligodendrocyte glycoprotein antibody-associated disease (MOGAD): a review of clinical and MRI features, diagnosis, and management. Front Neurol 2022;13:885218.



15. Salama S, Khan M, Shanechi A, Levy M, Izbudak I. MRI differences between MOG antibody disease and AQP4 NMOSD. Mult Scler 2020;26:1854-1865.




16. Kim HJ, Paul F, Lana-Peixoto MA, Tenembaum S, Asgari N, Palace J, et al. MRI characteristics of neuromyelitis optica spectrum disorder: an international update. Neurology 2015;84:1165-1173.


17. Banwell B, Bennett JL, Marignier R, Kim HJ, Brilot F, Flanagan EP, et al. Diagnosis of myelin oligodendrocyte glycoprotein antibody-associated disease: International MOGAD Panel proposed criteria. Lancet Neurol 2023;22:268-282.


18. Jurynczyk M, Tackley G, Kong Y, Geraldes R, Matthews L, Woodhall M, et al. Brain lesion distribution criteria distinguish MS from AQP4-antibody NMOSD and MOG-antibody disease. J Neurol Neurosurg Psychiatry 2017;88:132-136.


19. Harrison DM, Oh J, Roy S, Wood ET, Whetstone A, Seigo MA, et al. Thalamic lesions in multiple sclerosis by 7T MRI: clinical implications and relationship to cortical pathology. Mult Scler 2015;21:1139-1150.




20. Cagol A, Cortese R, Barakovic M, Schaedelin S, Ruberte E, Absinta M, et al. Diagnostic performance of cortical lesions and the central vein sign in multiple sclerosis. JAMA Neurol 2024;81:143-153.



21. Maggi P, Sati P, Nair G, Cortese ICM, Jacobson S, Smith BR, et al. Paramagnetic rim lesions are specific to multiple sclerosis: an international multicenter 3T MRI study. Ann Neurol 2020;88:1034-1042.




22. Matsumoto Y, Misu T, Mugikura S, Takai Y, Nishiyama S, Kuroda H, et al. Distinctive lesions of brain MRI between MOG-antibody-associated and AQP4-antibody-associated diseases. J Neurol Neurosurg Psychiatry 2021;92:682-684.

23. Sechi E, Krecke KN, Messina SA, Buciuc M, Pittock SJ, Chen JJ, et al. Comparison of MRI lesion evolution in different central nervous system demyelinating disorders. Neurology 2021;97:e1097-e1109.



25. Hyun JW, Kim SH, Jeong IH, Lee SH, Kim HJ. Bright spotty lesions on the spinal cord: an additional MRI indicator of neuromyelitis optica spectrum disorder? J Neurol Neurosurg Psychiatry 2015;86:1280-1282.


26. Hyun JW, Lee HL, Park J, Kim J, Min JH, Kim BJ, et al. Brighter spotty lesions on spinal MRI help differentiate AQP4 antibody-positive NMOSD from MOGAD. Mult Scler 2022;28:989-992.



27. Dubey D, Pittock SJ, Krecke KN, Morris PP, Sechi E, Zalewski NL, et al. Clinical, radiologic, and prognostic features of myelitis associated with myelin oligodendrocyte glycoprotein autoantibody. JAMA Neurol 2019;76:301-309.



28. Mariano R, Messina S, Roca-Fernandez A, Leite MI, Kong Y, Palace JA. Quantitative spinal cord MRI in MOG-antibody disease, neuromyelitis optica and multiple sclerosis. Brain 2021;144:198-212.



29. Casserly C, Seyman EE, Alcaide-Leon P, Guenette M, Lyons C, Sankar S, et al. Spinal cord atrophy in multiple sclerosis: a systematic review and meta-analysis. J Neuroimaging 2018;28:556-586.



30. Tobin WO, Guo Y, Krecke KN, Parisi JE, Lucchinetti CF, Pittock SJ, et al. Diagnostic criteria for chronic lymphocytic inflammation with pontine perivascular enhancement respon-sive to steroids (CLIPPERS). Brain 2017;140:2415-2425.





 PDF Links
PDF Links PubReader
PubReader ePub Link
ePub Link Full text via DOI
Full text via DOI Download Citation
Download Citation Print
Print